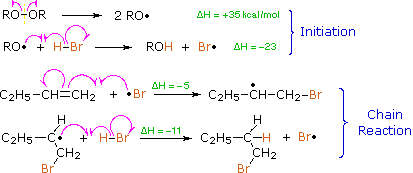My You tube online video link
Chemistry is Life
VishalPatel3438 Juna untarda
Saturday, 11 July 2020
Friday, 12 October 2018
NOBEL PRIZE 2018
રસાયણશાસ્ત્ર 2018 નો નોબલ પુરસ્કાર 3 વૈજ્ઞાનિકોને જાય છે: અહીં જ તેઓ જીત્યા છે
આ વૈજ્ઞાનિકોએ ડાર્વિનના સિદ્ધાંતને પ્રોટીન વિકસાવવા માટે લાગુ પાડ્યો હતો જે માનવજાતની રાસાયણિક સમસ્યાઓનો ઉકેલ લાવે છે. અહીંના અગાઉના નોબલ વિજેતા અને આ વર્ષે આપવામાં આવનારા આગામી નોબલ્સ છે.
યલ સ્વીડિશ એકેડેમી ઑફ સાયન્સિસે 10 ઓક્ટોબરના રોજ નોબેલ પ્રાઇઝના સમારંભમાં જણાવ્યું હતું કે ત્રણ સંશોધકો જેમણે કેમિસ્ટ્રીમાં આ વર્ષે નોબલ પુરસ્કાર એનાયત કર્યો હતો, તેએન્ઝાઇમ્સ અને એન્ટિબોડીઝને વિકસિત કરવા માટે " ઉત્ક્રાંતિની શક્તિનો ઉપયોગ કરે છે " જેણે નવા ફાર્માસ્યુટિકલ્સ અને બાયોફ્યુઅલનું નિર્માણ કર્યું છે - એપી દ્વારા અહેવાલ.
તેમને " પેપ્ટાઇડ્સ અને એન્ટિબોડીઝના તબક્કાના પ્રદર્શન " માટે સન્માનિત કરવામાં આવ્યા હતા.
કેમિસ્ટ્રીના વિજેતાના પરાક્રમી કામમાં 3 નોબેલ પુરસ્કાર
કેલિફોર્નિયા ઇન્સ્ટિટ્યુટ ઑફ ટેક્નોલૉજીના ફ્રાન્સિસ આર્નોલ્ડને એન્ઝાઇમ્સના પ્રથમ નિર્દેશિત ઉત્ક્રાંતિને સંચાલિત કરવા માટે અડધા પુરસ્કારથી પુરસ્કાર આપવામાં આવ્યો હતો, જેનાથી રસાયણોના વધુ પર્યાવરણીય રીતે મૈત્રીપૂર્ણ ઉત્પાદન, દવાઓ સહિત અને નવીનીકરણીય ઇંધણના ઉત્પાદનમાં પરિણમી હતી.
કેમ્બ્રિજ, ઈંગ્લેન્ડમાં મોલેક્યુલર બાયોલોજીના એમઆરસી લેબોરેટરીના મિઝોરી યુનિવર્સિટીના જ્યોર્જ સ્મિથ અને ગ્રેગરી વિન્ટર , ઇનામના બીજા ભાગનો ભાગ ભજવે છે.
સ્મિથે પ્રોટીન વિકસાવવા માટે એક નવી રીત વિકસાવી હતી અને વિન્ટર નવી દવાઓના ઉદ્દેશ્ય સાથે એન્ટિબોડીઝ વિકસિત કરવાની પદ્ધતિનો ઉપયોગ કરે છે.
આ એન્ટિબોડીઝ ઝેરને નિષ્ક્રિય કરી શકે છે, સ્વયંસંચાલિત સ્વયંસંચાલિત રોગો અને મેટાસ્ટેટિક કેન્સરનો ઉપચાર કરી શકે છે.
આ કાર્ય પર આધારિત પ્રથમ દવાનો ઉપયોગ રેમ્યુટોઇડ આર્થરાઈટિસ , સૉરાયિસિસ અને સોજાના આંતરડાના રોગ સામે થાય છે, એમ એકેડેમીએ જણાવ્યું હતું.
" આ વર્ષે નોબેલ પુરસ્કાર રસાયણશાસ્ત્રની શક્તિથી પ્રેરિત છે અને તે જ સિદ્ધાંતોનો ઉપયોગ કરે છે - આનુવંશિક પરિવર્તન અને પસંદગી - પ્રોટીન વિકસાવવા જે માનવજાતની રાસાયણિક સમસ્યાઓનું નિરાકરણ કરે છે ", એકેડેમીએ 1 મિલિયન ડૉલર આપવાનું એક નિવેદનમાં જણાવ્યું હતું. એનવાય ટાઇમ્સ મુજબ ઇનામ.
જ્યોર્જ સ્મિથને મળો
સ્મિથ, 77, બાયોલોજીકલ સાયન્સ વિભાગના મિઝોરી યુનિવર્સિટીમાં 40 વર્ષ માટે પ્રોફેસર હતા.
Thursday, 11 October 2018
NOBEL PRIZE
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1901 થી 2018 ની વચ્ચે નોબલ પારિતોષિકમાં 181 થી 110 વખત આપવામાં આવ્યો છે. ફ્રેડરિક સેંજર એકમાત્ર નોબલ એવોર્ડ છે જેણે 1958 અને 1980 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર એનાયત કર્યો હતો. આનો મતલબ એ છે કે કુલ 180 વ્યક્તિઓ રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર પ્રાપ્ત થયો છે. વધુ માહિતી મેળવવા માટે લિંક્સ પર ક્લિક કરો.
રસાયણશાસ્ત્ર 2018 માં નોબલ પુરસ્કાર
ફ્રાન્સિસ એચ. આર્નોલ્ડ "એન્ઝાઇમ્સના નિર્દેશિત ઉત્ક્રાંતિ માટે", જ્યોર્જ પી. સ્મિથ અને સર ગ્રેગરી પી. વિન્ટર "પેપ્ટાઇડ્સ અને એન્ટિબોડીઝના તબક્કાના પ્રદર્શન માટે".
રસાયણશાસ્ત્ર 2017 નો નોબલ પુરસ્કાર
સોલ્યુશનમાં બાયોમોલ્યુક્યુલેશનના ઉચ્ચ-રિઝોલ્યુશન માળખાના નિર્ધારણ માટે ક્રાયો ઇલેક્ટ્રોન માઇક્રોસ્કોપી વિકસાવવા માટે જેક્સ ડુબોશેટ , જોઆચિમ ફ્રેંક અને રિચાર્ડ હેન્ડરસન "
રસાયણશાસ્ત્ર 2016 નો નોબલ પુરસ્કાર
જીન-પિયર સોઉવેજ , સર જે. ફ્રેઝર સ્ટોડ્ડર્ટ અને બર્નાર્ડ એલ. ફિરિંગા "પરમાણુ મશીનોની ડિઝાઇન અને સંશ્લેષણ માટે"
રસાયણશાસ્ત્ર 2015 માં નોબેલ પુરસ્કાર
થોમસ લિન્ડહલ , પૌલ મોડરિચ અને અઝીઝ સેંસર "ડીએનએ રિપેરના યાંત્રિક અભ્યાસો માટે"
રસાયણશાસ્ત્ર 2014 માં નોબલ પુરસ્કાર
એરિક બેત્ઝીગ , સ્ટેફન ડબ્લ્યુ. હેલ અને વિલિયમ ઇ. મોર્નર "સુપર-રિઝોલ્વ્ડ ફ્લોરોસેન્સ માઇક્રોસ્કોપીના વિકાસ માટે"
રસાયણશાસ્ત્ર 2013 નો નોબલ પુરસ્કાર
જટિલ રાસાયણિક સિસ્ટમ્સ માટે મલ્ટીસ્કલે મોડેલ્સના વિકાસ માટે માર્ટિન કાર્પ્લસ , માઇકલ લેવિટ અને એરીહ વૉર્સેલ "
રસાયણશાસ્ત્ર 2012 નો નોબલ પુરસ્કાર
જી-પ્રોટીન-જોડાયેલા રીસેપ્ટર્સના અભ્યાસ માટે રોબર્ટ જે. લેફકોવિટ્ઝ અને બ્રાયન કે. કોબીલ્કા "
રસાયણશાસ્ત્ર 2011 નો નોબલ પુરસ્કાર
ડેન શેચટમેન "ક્વેસીક્રિસ્ટલ્સની શોધ માટે"
રસાયણશાસ્ત્ર 2010 નો નોબલ પુરસ્કાર
રિચાર્ડ એફ. હેક , ઇઇ-આઇચી નેગીશી અને અકીરા સુઝુકી "કાર્બનિક સંશ્લેષણમાં પેલેડિયમ-ઉત્પ્રેરિત ક્રોસ કપ્લીંગ્સ માટે"
રસાયણશાસ્ત્ર 2009 માં નોબેલ પુરસ્કાર
વિક્ટોરમન રામકૃષ્ણન , થોમસ એ. સ્ટીટ્ઝ અને ઍડા ઈ. યોનાથ " રિઝોસમના માળખા અને કાર્યના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2008 નો નોબલ પુરસ્કાર
ઓસામુ શિમોમુરા , માર્ટિન ચૅલ્ફી અને રોજર વાય. ત્સેન "ગ્રીન ફ્લોરોસન્ટ પ્રોટીનની શોધ અને વિકાસ માટે, જીએફપી"
2007 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
ગેર્હાર્ડ એર્ટલ "ઘન સપાટી પર રાસાયણિક પ્રક્રિયાઓના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2006 નો નોબલ પુરસ્કાર
રોજર ડી. કોર્નબર્ગ "યુકાર્યોટિક ટ્રાન્સક્રિપ્શનના પરમાણુ આધારના તેમના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2005 માં નોબલ પુરસ્કાર
યવેસ ચૌવીન , રોબર્ટ એચ. ગ્રુબ્સ અને રિચાર્ડ આર. શ્રોક "કાર્બનિક સંશ્લેષણમાં મેટાથેસિસ પદ્ધતિના વિકાસ માટે"
રસાયણશાસ્ત્ર 2004 માં નોબલ પુરસ્કાર
એબ્યુક સીઆકનૉવર , અવ્રમ હર્શે અને ઇરવીન રોઝ "યુબિકિટિન-મધ્યસ્થ પ્રોટીન ડિગ્રેડેશનની શોધ માટે"
રસાયણશાસ્ત્ર 2003 નો નોબલ પુરસ્કાર
"સેલ પટલમાં ચેનલોની શોધ માટે", પીટર એગ્રે "વૉટર ચેનલોની શોધ માટે", અને રોડરીક મૅકકીનન "આયન ચેનલોના માળખાકીય અને યાંત્રિક અભ્યાસો માટે"
રસાયણશાસ્ત્ર 2002 નો નોબલ પુરસ્કાર
"જૈવિક મૅક્રોમોલ્યુકલ્સની ઓળખ અને માળખા વિશ્લેષણ માટે પદ્ધતિઓના વિકાસ માટે"
જ્હોન બી. ફેન અને કોઇચી તનાકા "બાયોલોજિકલ મેક્રોમોલ્યુકલ્સના સામૂહિક સ્પેક્ટ્રૉમેટ્રિક વિશ્લેષણ માટે સોફ્ટ સોર્ટિંગ આયનોઇઝેશન પદ્ધતિઓના વિકાસ માટે".
સોલ્યુશનમાં જૈવિક મૅક્રોમોલ્યુક્યુલેસની ત્રિ-પરિમાણીય માળખું નક્કી કરવા માટે ન્યુક્લિયર મેગ્નેટિક રેઝોન્સ સ્પેક્ટ્રોસ્કોપીના વિકાસ માટે કુર્ટ વુથરિચ "
રસાયણશાસ્ત્ર 2001 માં નોબેલ પુરસ્કાર
વિલીયમ એસ. નોલ્સ અને રિઓજી નોયોરી "તેમના કામ માટે ચીરીયુક્ત હાઇડ્રોજનેશન પ્રતિક્રિયાઓ પર કાબૂ મેળવવા"
કે. બેરી શારપ્લેસ "તેના ચિકિત્સા માટે ઓક્સિડેશન પ્રતિક્રિયાઓ પરના કાર્યો માટે"
રસાયણશાસ્ત્ર 2000 નો નોબલ પુરસ્કાર
એલન જે. હેગર , એલન જી. મેકડીઆર્મિડ અને હૈદકી શિરાકાવા "વાહક પોલિમર્સની શોધ અને વિકાસ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1999
અહમદ એચ. ઝેવૈલે "ફેમટોસેકંડ સ્પેક્ટ્રોસ્કોપીનો ઉપયોગ કરીને રાસાયણિક પ્રતિક્રિયાઓના સંક્રમણ સ્થિતિના તેમના અભ્યાસ માટે"
કેમિસ્ટ્રી 1998 માં નોબલ પુરસ્કાર
વોલ્ટર કોહન "ઘનતા-કાર્યાત્મક થિયરીના વિકાસ માટે"
જ્હોન એ. પોપલ "ક્વોન્ટમ કેમિસ્ટ્રીમાં કમ્પ્યુટેશનલ પદ્ધતિઓના વિકાસ માટે"
1997 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
એડોનોસિન ટ્રાઇફોસ્ફેટ (એટીપી) ના સંશ્લેષણ હેઠળના એન્ઝાઇમેટિક મિકેનિઝમના તેમના વિશ્લેષણ માટે પોલ ડી. બોયર અને જ્હોન ઇ. વૉકર "
આયન-પરિવહન એન્ઝાઇમ, ના +, કે + -ATPase ની પ્રથમ શોધ માટે જેન્સ સી. સ્કૂ "
1996 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
રોબર્ટ એફ. કર્લ જુનિયર , સર હેરોલ્ડ ડબ્લ્યુ. ક્રેટો અને રિચાર્ડ ઇ . સ્મેલી "ફોર ડીલવરી ઑફ ફ્લુરેન્સ"
1995 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
પૌલ જે. ક્રુટઝન , મારિયો જે. મોલિના અને એફ. શેરવુડ રોલેન્ડ "વાતાવરણીય રસાયણશાસ્ત્રમાં તેમના કામ માટે, ખાસ કરીને ઓઝોનની રચના અને વિઘટન સંબંધિત"
1994 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જ્યોર્જ એ. ઓલાહ "કાર્બોકેશન રસાયણશાસ્ત્રમાં તેમના યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1993
"ડીએનએ આધારિત રસાયણશાસ્ત્રની પદ્ધતિઓના વિકાસમાં યોગદાન માટે"
પોલિમેઝ ચેઇન રિએક્શન (પીસીઆર) પદ્ધતિની શોધ માટે કેરી બી. મુલિસ "
માઈકલ સ્મિથ "ઓલિગોન્યુક્લિઓટાઇડ-આધારિત, સાઇટ-નિર્દેશિત મ્યુટેજેનેસિસ અને પ્રોટીન અભ્યાસો માટે તેના વિકાસની સ્થાપનામાં તેમના મૂળભૂત યોગદાન માટે"
1992 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રુડોલ્ફ એ. માર્કસ "રાસાયણિક સિસ્ટમ્સમાં ઇલેક્ટ્રોન ટ્રાન્સફર પ્રતિક્રિયાઓના થિયરીમાં તેમના યોગદાન માટે"
1991 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
રિચાર્ડ આર. અર્ન્સ્ટ "ઉચ્ચ રીઝોલ્યુશન પરમાણુ ચુંબકીય પ્રતિસાદ (એનએમઆર) સ્પેક્ટ્રોસ્કોપીની પદ્ધતિના વિકાસમાં તેમના યોગદાન માટે"
કેમિસ્ટ્રી 1990 માં નોબેલ પુરસ્કાર
એલિયાસ જેમ્સ કોરી "તેના સિદ્ધાંત અને કાર્બનિક સંશ્લેષણની કાર્યવાહીના વિકાસ માટે"
કેમિસ્ટ્રી 1989 માં નોબલ પુરસ્કાર
સિડની ઓલ્ટમેન અને થોમસ આર. સેચ "આરએનએના ઉત્પ્રેરક ગુણધર્મોની શોધ માટે"
કેમિસ્ટ્રી 1988 માં નોબેલ પુરસ્કાર
જોહાન ડેઇઝહોફ્ફર , રોબર્ટ હ્યુબર અને હાર્ટમટ મિશેલ "પ્રકાશસંશ્લેષણ પ્રતિક્રિયા કેન્દ્રની ત્રિ-પરિમાણીય માળખાના નિર્ધારણ માટે"
રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર 1987
ડોનાલ્ડ જે. ક્રેમ , જીન-મેરી લેહ્ન અને ચાર્લ્સ જે. પેડર્સન "તેમના વિકાસ અને ઉચ્ચ પસંદગીની રચના-વિશિષ્ટ ક્રિયાપ્રતિક્રિયાઓ સાથેના પરમાણુઓના ઉપયોગ માટે"
કેમિસ્ટ્રી 1986 માં નોબલ પુરસ્કાર
ડુડલી આર. હર્સચબાચ , યુઆન ટી. લી અને જ્હોન સી. પોલેની "રાસાયણિક પ્રારંભિક પ્રક્રિયાઓની ગતિશીલતાને લગતા તેમના યોગદાન માટે"
1985 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હર્બર્ટ એ. હ્યુપ્ટમેન અને જેરોમ કાર્લે "ક્રિસ્ટલ માળખાના નિર્ધારણ માટે સીધા પદ્ધતિઓના વિકાસમાં તેમની ઉત્કૃષ્ટ સિદ્ધિઓ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1984
રોબર્ટ બ્રુસ મેરિફિલ્ડ "નક્કર મેટ્રિક્સ પર રાસાયણિક સંશ્લેષણ માટે પદ્ધતિના વિકાસ માટે"
1983 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હેનરી ટેબે "ઇલેક્ટ્રોન ટ્રાન્સફર પ્રતિક્રિયાઓના મેકેનિઝમ પરના તેમના કાર્ય માટે, ખાસ કરીને મેટલ સંકુલમાં"
1982 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
એરોન ક્લુગ "ક્રિસ્ટલોગ્રાફિક ઇલેક્ટ્રોન માઇક્રોસ્કોપીના વિકાસ માટે અને બાયોલોજિકલી અગત્યના ન્યુક્લિયર એસિડ-પ્રોટીન સંકુલના તેના માળખાકીય વિશ્લેષણ માટે"
1981 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કેનીચી ફુકુઇ અને રોઆલ્ડ હોફમેન "તેમના સિદ્ધાંતો માટે, રાસાયણિક પ્રતિક્રિયાઓના અભ્યાસ માટે સ્વતંત્ર રીતે વિકસિત થયા હતા"
કેમિસ્ટ્રીમાં નોબેલ પુરસ્કાર 1980
પાઉલ બર્ગ "ન્યુક્લિક એસિડ્સની બાયોકેમિસ્ટ્રીના તેના મૂળભૂત અભ્યાસ માટે, ખાસ કરીને રિકોમ્બિનન્ટ-ડીએનએના સંદર્ભમાં"
વોલ્ટર ગિલ્બર્ટ અને ફ્રેડરિક સેંજર "ન્યુક્લિક એસિડ્સમાં બેઝ સિક્વન્સના નિર્ધારણ અંગેના તેમના યોગદાન માટે"
1979 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
હર્બર્ટ સી. બ્રાઉન અને જ્યોર્જ વિટીગ "બૉરોન અને ફોસ્ફરસ-સંયોજક સંયોજનોના ઉપયોગના તેમના વિકાસ માટે, અનુક્રમે, કાર્બનિક સંશ્લેષણમાં મહત્વપૂર્ણ ઘટકોમાં"
1978 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કેમોસમોટિક સિદ્ધાંતની રચના દ્વારા જૈવિક ઉર્જા પરિવહનની સમજણમાં તેમના યોગદાન બદલ પીટર ડી. મિશેલ "
1977 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ઇલિયા પ્રિગૉગિન "બિન સંતુલિત થર્મોડાયનેમિક્સમાં તેના યોગદાન માટે, ખાસ કરીને ડિસિપ્પીટીવ સ્ટ્રક્ચરની થિયરી"
1976 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલિયમ એન. લિપ્સકોમ્બ "રાસાયણિક બંધનની સમસ્યાઓને પ્રકાશિત કરતી બોરેનની રચના પરના તેમના અભ્યાસ માટે"
1975 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જ્હોન વૉર્કઅપ કોર્નફોર્થ "એન્ઝાઇમ-ઉત્પ્રેરિત પ્રતિક્રિયાઓના સ્ટીરિયોકેમિસ્ટ્રી પરના તેમના કાર્ય માટે"
વ્લાદિમીર પ્રિલોગ "કાર્બનિક પરમાણુ અને પ્રતિક્રિયાઓના સ્ટીરિયોકેમિસ્ટ્રીમાં સંશોધન માટે"
1974 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
પાઉલ જે. ફ્લોરી "તેના મૂળ સિધ્ધાંતો માટે, સૈદ્ધાંતિક અને પ્રાયોગિક બંને, મૅક્રોમોલ્યુકલ્સની ભૌતિક રસાયણશાસ્ત્રમાં"
1973 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
અર્નેસ્ટ ઓટો ફિશેર અને જીઓફ્રી વિલ્કિન્સન "તેમના અગ્રણી કાર્ય માટે, સ્વતંત્ર રીતે રજૂ કર્યું, એર્ગોમેટેમિકની રસાયણશાસ્ત્ર પર, જેને કહેવાતા સેન્ડવિચ સંયોજનો"
1972 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ક્રિશ્ચિયન બી. એન્ફિન્સન "રિબોન્યુક્લીઝ પરના તેમના કામ માટે, ખાસ કરીને એમિનો એસિડ અનુક્રમણિકા અને જીવવિજ્ઞાની સક્રિય રચના વચ્ચેના સંબંધને લગતા"
સ્ટેનફોર્ડ મૂર અને વિલિયમ એચ. સ્ટીન "રિઓનકુક્લીઝ અણુના સક્રિય કેન્દ્રના રાસાયણિક માળખા અને ઉત્પ્રેરક પ્રવૃત્તિ વચ્ચેનાં જોડાણની સમજણમાં તેમના યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1971
ગેરહાર્ડ હર્ઝબર્ગ "તેના પર ઇલેક્ટ્રોનિક માળખા અને અણુઓની ભૂમિતિ, ખાસ કરીને મુક્ત રેડિકલના જ્ઞાનમાં યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1970
લ્યુઇસ એફ. લિલોઇર "તેમની શોધ માટે ખાંડ ન્યુક્લિયોટાઇડ્સ અને કાર્બોહાઇડ્રેટ્સના બાયોસિન્થેસિસમાં તેમની ભૂમિકા"
1969 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ડેરેક એચઆર બાર્ટન અને ઑડ હસેલ " રચનાના ખ્યાલના વિકાસમાં અને તેના રસાયણશાસ્ત્રમાં તેની રજૂઆત માટેના યોગદાન માટે"
1968 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
લાર્સ ઑન્સેસર "તેમના નામને લગતા પારસ્પરિક સંબંધોની શોધ માટે, જે અપ્રગટ પ્રક્રિયાઓની થર્મોડાયનેમિક્સ માટે મૂળભૂત છે."
1967 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
મેનફ્રેડ ઇજેન , રોનાલ્ડ જ્યોર્જ વેરેફોર્ડ નોરિશ અને જ્યોર્જ પોર્ટર "અત્યંત ઝડપી રાસાયણિક પ્રતિક્રિયાઓના અભ્યાસ માટે, ઊર્જાના ખૂબ ટૂંકા કઠોળ દ્વારા સંતુલનને ખલેલ પહોંચાડે છે"
1966 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રોબર્ટ એસ. મુલિકેન "રાસાયણિક બોન્ડ અને પરમાણુ ઓર્બિટલ પદ્ધતિ દ્વારા પરમાણુના ઇલેક્ટ્રોનિક માળખા અંગેના તેના મૂળભૂત કાર્ય માટે"
1965 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
રોબર્ટ બર્ન્સ વુડવર્ડ "કાર્બનિક સંશ્લેષણની આર્ટમાં તેમની ઉત્કૃષ્ટ સિદ્ધિઓ માટે"
1964 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ડોરોથી ક્રોફફૂટ હોજકિન "મહત્વપૂર્ણ બાયોકેમિકલ પદાર્થોના માળખાના એક્સ-રે તકનીકો દ્વારા તેના નિર્ણયો માટે"
1963 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કાર્લ ઝિગલર અને જિયુલિઓ નત્તા "કેમિસ્ટ્રી અને ઉચ્ચ પોલિમર્સની તકનીકમાં તેમની શોધ માટે"
1962 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
મેક્સ ફર્ડિનાન્ડ પેરુત્ઝ અને જ્હોન કેઉડરી કેન્ડ્રુ "ગ્લોબ્યુલર પ્રોટીનની રચનાઓના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 1961 માં નોબલ પુરસ્કાર
મેલ્વિન કેલ્વિન "છોડમાં કાર્બન ડાયોક્સાઇડ એસિમિલેશન પર સંશોધન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1960
વિલેર્ડ ફ્રેન્ક લિબી "પુરાતત્ત્વશાસ્ત્ર, ભૂસ્તરશાસ્ત્ર, ભૂસ્તરશાસ્ત્ર અને વિજ્ઞાનની અન્ય શાખાઓમાં વય નિર્ધારણ માટે કાર્બન -14 નો ઉપયોગ કરવાની તેમની પદ્ધતિ માટે"
1959 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જરોસ્લાવ હીરોવ્સ્કી "તેની શોધ અને વિશ્લેષણના પોલરાગ્રાફિક પદ્ધતિઓના વિકાસ માટે"
1958 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રેડરિક સેન્જર "પ્રોટીનની રચના પર તેના કામ માટે, ખાસ કરીને ઇન્સ્યુલિનની"
1957 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
લોર્ડ (એલેક્ઝાન્ડર આર.) ટોડ "ન્યુક્લિયોટાઈડ્સ અને ન્યુક્લિયોટાઇડ સહ-એન્ઝાઇમ્સ પરના તેમના કામ માટે"
1956 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
સર સિરિલ નોર્મન હિન્સેલવુડ અને નિકોલે નિકોલાવીચ સેમેનોવ "તેમના સંશોધન માટે રાસાયણિક પ્રતિક્રિયાઓની પદ્ધતિમાં"
1955 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
વિન્સેન્ટ ડુ વિગ્નેડ "બાયોકેમિકલી અગત્યના સલ્ફર સંયોજનો પરના તેમના કાર્ય માટે, ખાસ કરીને પોલિપેપ્ટાઇડ હોર્મોનના પ્રથમ સંશ્લેષણ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1954
લીનસ કાર્લ પૌલીંગ "રાસાયણિક બોન્ડની પ્રકૃતિમાં તેના સંશોધન માટે અને જટિલ પદાર્થોના માળખાની સ્પષ્ટતા માટે તેની અરજી"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1953
હર્મન સ્ટૌડીંગર "મેક્રોમોલેક્યુલર કેમિસ્ટ્રીના ક્ષેત્રમાં તેની શોધ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1952
આર્ચર જ્હોન પોર્ટર માર્ટિન અને રિચાર્ડ લોરેન્સ મિલીંગ્ટન સિંજ "પાર્ટીશન ક્રોમેટોગ્રાફીની શોધ માટે"
1951 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
એડવિન મેટિસન મેકમિલન અને ગ્લેન થિયોડોર સીબોર્ગ "ટ્રાન્સએરેનિયમ તત્વોના રસાયણશાસ્ત્રમાં તેમની શોધ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1950
ઑટો પૌલ હર્મન ડાયલ્સ અને કર્ટ એલ્ડર "તેમની શોધ અને ડિયાન સંશ્લેષણના વિકાસ માટે"
1949 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલિયમ ફ્રાન્સિસ ગિયાક "રાસાયણિક થર્મોડાયનેમિક્સના ક્ષેત્રમાં તેમના યોગદાન માટે, ખાસ કરીને અત્યંત ઓછી તાપમાને પદાર્થોની વર્તણૂંક સંબંધિત"
1948 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એરેન વિલ્હેમ કૌરિન ટિસેલિયસ "ઇલેક્ટ્રોફોર્સિસ અને શોષણ વિશ્લેષણ અંગેના તેમના સંશોધન માટે, ખાસ કરીને સીરમ પ્રોટીનની જટિલ પ્રકૃતિ સંબંધિત તેની શોધ માટે"
1947 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
સર રોબર્ટ રોબિન્સન "જૈવિક મહત્વના છોડના ઉત્પાદનો અંગેની તેમની તપાસ માટે, ખાસ કરીને ઍલ્કલોઇડ્સ"
1946 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જેમ્સ બૅથેલર સુમનર "તેની શોધ માટે કે એન્ઝાઇમ્સ સ્ફટિકીકરણ કરી શકાય છે"
જ્હોન હોવર્ડ નોર્થ્રોપ અને વેન્ડેલ મેરિડિથ સ્ટેનલી "તેમના શુદ્ધ સ્વરૂપમાં એન્ઝાઇમ્સ અને વાયરસ પ્રોટીનની તૈયારી માટે"
1945 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
અર્તૂરી ઈલ્મારી ફ્યુટેનને "તેના સંશોધન અને શોધ માટે કૃષિ અને પોષણ રસાયણશાસ્ત્રમાં સંશોધન, ખાસ કરીને તેના ચારા સંરક્ષણ પદ્ધતિ માટે"
1944 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ઓટ્ટો હેન "ભારે ન્યુક્લિયાની ફિશશનની શોધ માટે"
1943 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
જ્યોર્જ ડે હેવેસી "રાસાયણિક પ્રક્રિયાઓના અભ્યાસમાં આઇસોટોપ્સના ઉપયોગ પરના તેના કામ માટેના ટ્રેસર્સ તરીકે"
1942 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1941 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1940 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1939 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડોલ્ફ ફ્રેડરિચ જોહ્ન બ્યુએનનેટ્ટ "સેક્સ હોર્મોન્સ પરના તેમના કામ માટે"
લિયોપોલ્ડ રુઝિકા "પોલિમિથિલેન્સ અને ઉચ્ચ ટેપરિન્સ પરના તેમના કામ માટે"
1938 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રિચાર્ડ કુહ્ન "કેરોટીનોઇડ્સ અને વિટામિન્સ પરના તેમના કામ માટે"
1937 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કાર્બોહાઇડ્રેટ્સ અને વિટામિન સી પર તેની તપાસ માટે વોલ્ટર નોર્મન હોઉથ "
પાઉલ કેરર "કેરોટીનોઇડ્સ, ફ્લેવિન્સ અને વિટામિન્સ એ અને બી 2 પર તેમની તપાસ માટે"
1936 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
પેટ્રુસ (પીટર) જોસેફસ વિલ્હેમમસ ડબ્બી " દ્વિપકલ્પના ક્ષણો પર અને એક્સ-રે અને વાયુઓમાં ઇલેક્ટ્રોનના વિસર્જન પર તેની તપાસ દ્વારા પરમાણુ માળખાના અમારા જ્ઞાનમાં યોગદાન બદલ"
1935 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રેડેરિક Joliot અને ઇરેન જોલિઓટ-ક્યુરી "નવા કિરણોત્સર્ગી તત્વો તેમના સંશ્લેષણ માન્યતા માં"
1934 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
હેરોલ્ડ ક્લેટોન ઉરે "તેની શોધ માટે ભારે હાઇડ્રોજન"
1933 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1932
ઇરવિંગ લેંગમુઇર "તેની શોધ અને સપાટીની રસાયણશાસ્ત્રમાં તપાસ માટે"
1931 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કાર્લ બોશ અને ફ્રેડરિક બર્ગિયસ "રાસાયણિક ઉચ્ચ દબાણ પદ્ધતિઓના સંશોધન અને વિકાસમાં તેમના યોગદાનને માન્યતા આપતા"
1930 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હંસ ફિશર "તેના સંશોધન માટે હેમેઈન અને હરિતદ્રવ્યના બંધારણમાં અને ખાસ કરીને હેમેઈનના તેના સંશ્લેષણ માટે"
1929 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
આર્થર હાર્ડેન અને હંસ કાર્લ ઑગસ્ટ સિમોન વોન યુલર-ચેપ્પીન "ખાંડ અને આથોના ઉત્સેચકોની આથો પર તેમની તપાસ માટે"
1928 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડોલ્ફ ઓટ્ટો રેઇનહોલ્ડ વિન્ડૉસ " સ્ટર્ોલ્સના બંધારણમાં તેમના સંશોધન દ્વારા અને વિટામિન્સ સાથેના તેમના જોડાણ દ્વારા પ્રસ્તુત સેવાઓ માટે"
1927 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
બાયલ એસિડ્સ અને સંબંધિત પદાર્થોના બંધારણની તેની તપાસ માટે હેનરિચ ઑટો વાઇલેન્ડ "
1926 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
(થિયોડોર) સ્વેર્ડબર્ગ " વિખેરવાની વ્યવસ્થા પરના તેમના કાર્ય માટે"
1925 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
રિચાર્ડ એડોલ્ફ ઝ્સિગ્મોન્ડી "કોલોઇડ સોલ્યુશન્સની વિષમ પ્રકૃતિના તેમના નિદર્શન માટે અને તેણે ઉપયોગમાં લેવાતી પદ્ધતિઓ માટે, જે ત્યારથી આધુનિક કોલોઇડ રસાયણશાસ્ત્રમાં મૂળભૂત બની ગયું છે"
1924 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1923 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કાર્બનિક પદાર્થોના સૂક્ષ્મ વિશ્લેષણની પદ્ધતિની શોધ માટે ફ્રિટ્ઝ પ્રિગ "
1922 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ફ્રાન્સિસ વિલિયમ એસ્ટોન "તેની શોધ માટે, તેના સામૂહિક વર્ણપટ્ટાકૃતિ દ્વારા, આઇસોટોપ્સની, મોટી સંખ્યામાં બિન-કિરણોત્સર્ગી તત્વોમાં, અને સંપૂર્ણ-અંકુશના નિયમની તેમની પ્રતિજ્ઞા માટે"
1921 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ફ્રેડરિક સોડ્ડી "કિરણોત્સર્ગી પદાર્થોના રસાયણશાસ્ત્રના અમારા જ્ઞાનમાં, અને આઇસોટોપ્સના મૂળ અને પ્રકૃતિમાં તેની તપાસમાં યોગદાન બદલ"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1920
વોલ્થર હર્મન નર્નેસ્ટ "થર્મોકેમિસ્ટ્રીમાં તેમના કામની ઓળખમાં"
1919 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1918 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રિટ્ઝ હેબર "તેના તત્વોમાંથી એમોનિયાના સંશ્લેષણ માટે"
1917 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
રસાયણશાસ્ત્ર 1916 નો નોબલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1915 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રિચાર્ડ માર્ટિન વિલ્સ્ટટર "છોડના રંગદ્રવ્યો પર તેના સંશોધન માટે, ખાસ કરીને હરિતદ્રવ્ય"
1914 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
થિયોડોર વિલિયમ રિચાર્ડ્સ "રાસાયણિક ઘટકોની મોટી સંખ્યાના પરમાણુ વજનના તેના ચોક્કસ નિર્ણયોને માન્યતા આપતા"
1913 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આલ્ફ્રેડ વર્નર "પરમાણુઓના અણુઓના જોડાણ પરના તેમના કાર્યને માન્યતા આપીને તેમણે અગાઉની તપાસ પર નવો પ્રકાશ ફેંક્યો હતો અને ખાસ કરીને અકાર્બનિક રસાયણશાસ્ત્રમાં સંશોધનના નવા ક્ષેત્રો ખોલ્યા હતા."
1912 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિક્ટર ગ્રિગાર્ડ "કહેવાતા ગ્રિગાર્ડ રીજેન્ટની શોધ માટે, જે તાજેતરના વર્ષોમાં કાર્બનિક રસાયણશાસ્ત્રની પ્રગતિને ખૂબ જ અદ્યતન કરે છે"
પાઉલ સબાટિઅર "ઉડી ગયેલી ધાતુઓની હાજરીમાં કાર્બનિક સંયોજનોને હાઇડ્રોજન કરતી પદ્ધતિ માટે, જેમાં તાજેતરના વર્ષોમાં કાર્બનિક રસાયણશાસ્ત્રની પ્રગતિ ખૂબ જ અદ્યતન થઈ છે"
1911 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
મેરી ક્યુરી, ને સ્ક્લોડોડ્સ્કા " રેડીયમના એકાંત દ્વારા અને રસાયણના એકાંત દ્વારા અને આ નોંધપાત્ર તત્વના સંયોજનોના અભ્યાસ દ્વારા રાસાયિયમ અને પોલોનીયમની શોધ દ્વારા રસાયણશાસ્ત્રની પ્રગતિ માટે તેમની સેવાઓની માન્યતામાં"
1910 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ઑટો વૅલૅચ "એલિસાયક્લિક સંયોજનોના ક્ષેત્રે તેના અગ્રણી કાર્ય દ્વારા કાર્બનિક રસાયણશાસ્ત્ર અને રાસાયણિક ઉદ્યોગે તેમની સેવાઓને માન્યતા આપીને"
1909 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલ્હેમ ઓસ્ટવાલ્ડ " કેટાલિસિસ પરના તેમના કાર્યને માન્યતા આપવા અને રાસાયણિક સમતુલાને નિયંત્રિત કરતી મૂળભૂત સિદ્ધાંતોમાં તેમની તપાસ માટે અને પ્રતિક્રિયાના દર"
1908 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
અર્નેસ્ટ રધરફર્ડ "તત્વોના વિઘટનમાં તેની તપાસ માટે અને કિરણોત્સર્ગી પદાર્થોની રસાયણશાસ્ત્ર"
1907 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડવર્ડ બ્યુકેનર "તેમના બાયોકેમિકલ સંશોધનો અને સેલ-ફ્રી આથોની શોધ માટે"
1906 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હેનરી મોઇઝન "તેમની તપાસ અને તત્વ ફ્લોરોઇનની અલગતા અને ઇલેક્ટ્રિક ભઠ્ઠીના વિજ્ઞાનની સેવામાં તેને અપનાવવા બદલ તેમની દ્વારા આપવામાં આવતી મોટી સેવાઓને માન્યતા આપતા"
1905 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
જહોન ફ્રેડરિક વિલ્હેમ એડોલ્ફ વોન બેયર "કાર્બનિક રંગો અને હાઇડ્રોરોમેટિક સંયોજનો પરના તેમના કાર્ય દ્વારા કાર્બનિક રસાયણશાસ્ત્ર અને રાસાયણિક ઉદ્યોગોના વિકાસમાં તેમની સેવાઓને માન્યતા આપતા"
1904 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
સર વિલિયમ રામસેએ "હવાના નિષ્ક્રિય વાયુઓના તત્વોની શોધમાં તેમની સેવાઓને માન્યતા આપી અને સમયાંતરે તેમની સ્થિતીનું નિર્ધારણ કર્યું."
1903 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
સ્વેન્ટે ઑગસ્ટ એરેનિયિયસ "અસાધારણ સેવાઓની માન્યતામાં તેમણે રસાયણશાસ્ત્રના વિકાસને તેના વિસર્જનના વિદ્યુતવિજ્ઞાન સિદ્ધાંત દ્વારા પ્રદાન કર્યું છે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1902
હર્મન એમિલ ફિશર "તેમણે ખાંડ અને શુદ્ધ સંશ્લેષણ પરના તેમના કાર્ય દ્વારા અસાધારણ સેવાઓને માન્યતા આપતા"
1901 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જેકબસ હેન્રીકસ વેન ટી હોફ "અસાધારણ સેવાઓને માન્યતા આપીને, રાસાયણિક ગતિશીલતાના નિયમો અને ઉકેલોમાં ઓસમોટિક દબાણના અધ્યયન દ્વારા તેને રજૂ કરે છે
રસાયણશાસ્ત્ર 2018 માં નોબલ પુરસ્કાર
ફ્રાન્સિસ એચ. આર્નોલ્ડ "એન્ઝાઇમ્સના નિર્દેશિત ઉત્ક્રાંતિ માટે", જ્યોર્જ પી. સ્મિથ અને સર ગ્રેગરી પી. વિન્ટર "પેપ્ટાઇડ્સ અને એન્ટિબોડીઝના તબક્કાના પ્રદર્શન માટે".
રસાયણશાસ્ત્ર 2017 નો નોબલ પુરસ્કાર
સોલ્યુશનમાં બાયોમોલ્યુક્યુલેશનના ઉચ્ચ-રિઝોલ્યુશન માળખાના નિર્ધારણ માટે ક્રાયો ઇલેક્ટ્રોન માઇક્રોસ્કોપી વિકસાવવા માટે જેક્સ ડુબોશેટ , જોઆચિમ ફ્રેંક અને રિચાર્ડ હેન્ડરસન "
રસાયણશાસ્ત્ર 2016 નો નોબલ પુરસ્કાર
જીન-પિયર સોઉવેજ , સર જે. ફ્રેઝર સ્ટોડ્ડર્ટ અને બર્નાર્ડ એલ. ફિરિંગા "પરમાણુ મશીનોની ડિઝાઇન અને સંશ્લેષણ માટે"
રસાયણશાસ્ત્ર 2015 માં નોબેલ પુરસ્કાર
થોમસ લિન્ડહલ , પૌલ મોડરિચ અને અઝીઝ સેંસર "ડીએનએ રિપેરના યાંત્રિક અભ્યાસો માટે"
રસાયણશાસ્ત્ર 2014 માં નોબલ પુરસ્કાર
એરિક બેત્ઝીગ , સ્ટેફન ડબ્લ્યુ. હેલ અને વિલિયમ ઇ. મોર્નર "સુપર-રિઝોલ્વ્ડ ફ્લોરોસેન્સ માઇક્રોસ્કોપીના વિકાસ માટે"
રસાયણશાસ્ત્ર 2013 નો નોબલ પુરસ્કાર
જટિલ રાસાયણિક સિસ્ટમ્સ માટે મલ્ટીસ્કલે મોડેલ્સના વિકાસ માટે માર્ટિન કાર્પ્લસ , માઇકલ લેવિટ અને એરીહ વૉર્સેલ "
રસાયણશાસ્ત્ર 2012 નો નોબલ પુરસ્કાર
જી-પ્રોટીન-જોડાયેલા રીસેપ્ટર્સના અભ્યાસ માટે રોબર્ટ જે. લેફકોવિટ્ઝ અને બ્રાયન કે. કોબીલ્કા "
રસાયણશાસ્ત્ર 2011 નો નોબલ પુરસ્કાર
ડેન શેચટમેન "ક્વેસીક્રિસ્ટલ્સની શોધ માટે"
રસાયણશાસ્ત્ર 2010 નો નોબલ પુરસ્કાર
રિચાર્ડ એફ. હેક , ઇઇ-આઇચી નેગીશી અને અકીરા સુઝુકી "કાર્બનિક સંશ્લેષણમાં પેલેડિયમ-ઉત્પ્રેરિત ક્રોસ કપ્લીંગ્સ માટે"
રસાયણશાસ્ત્ર 2009 માં નોબેલ પુરસ્કાર
વિક્ટોરમન રામકૃષ્ણન , થોમસ એ. સ્ટીટ્ઝ અને ઍડા ઈ. યોનાથ " રિઝોસમના માળખા અને કાર્યના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2008 નો નોબલ પુરસ્કાર
ઓસામુ શિમોમુરા , માર્ટિન ચૅલ્ફી અને રોજર વાય. ત્સેન "ગ્રીન ફ્લોરોસન્ટ પ્રોટીનની શોધ અને વિકાસ માટે, જીએફપી"
2007 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
ગેર્હાર્ડ એર્ટલ "ઘન સપાટી પર રાસાયણિક પ્રક્રિયાઓના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2006 નો નોબલ પુરસ્કાર
રોજર ડી. કોર્નબર્ગ "યુકાર્યોટિક ટ્રાન્સક્રિપ્શનના પરમાણુ આધારના તેમના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 2005 માં નોબલ પુરસ્કાર
યવેસ ચૌવીન , રોબર્ટ એચ. ગ્રુબ્સ અને રિચાર્ડ આર. શ્રોક "કાર્બનિક સંશ્લેષણમાં મેટાથેસિસ પદ્ધતિના વિકાસ માટે"
રસાયણશાસ્ત્ર 2004 માં નોબલ પુરસ્કાર
એબ્યુક સીઆકનૉવર , અવ્રમ હર્શે અને ઇરવીન રોઝ "યુબિકિટિન-મધ્યસ્થ પ્રોટીન ડિગ્રેડેશનની શોધ માટે"
રસાયણશાસ્ત્ર 2003 નો નોબલ પુરસ્કાર
"સેલ પટલમાં ચેનલોની શોધ માટે", પીટર એગ્રે "વૉટર ચેનલોની શોધ માટે", અને રોડરીક મૅકકીનન "આયન ચેનલોના માળખાકીય અને યાંત્રિક અભ્યાસો માટે"
રસાયણશાસ્ત્ર 2002 નો નોબલ પુરસ્કાર
"જૈવિક મૅક્રોમોલ્યુકલ્સની ઓળખ અને માળખા વિશ્લેષણ માટે પદ્ધતિઓના વિકાસ માટે"
જ્હોન બી. ફેન અને કોઇચી તનાકા "બાયોલોજિકલ મેક્રોમોલ્યુકલ્સના સામૂહિક સ્પેક્ટ્રૉમેટ્રિક વિશ્લેષણ માટે સોફ્ટ સોર્ટિંગ આયનોઇઝેશન પદ્ધતિઓના વિકાસ માટે".
સોલ્યુશનમાં જૈવિક મૅક્રોમોલ્યુક્યુલેસની ત્રિ-પરિમાણીય માળખું નક્કી કરવા માટે ન્યુક્લિયર મેગ્નેટિક રેઝોન્સ સ્પેક્ટ્રોસ્કોપીના વિકાસ માટે કુર્ટ વુથરિચ "
રસાયણશાસ્ત્ર 2001 માં નોબેલ પુરસ્કાર
વિલીયમ એસ. નોલ્સ અને રિઓજી નોયોરી "તેમના કામ માટે ચીરીયુક્ત હાઇડ્રોજનેશન પ્રતિક્રિયાઓ પર કાબૂ મેળવવા"
કે. બેરી શારપ્લેસ "તેના ચિકિત્સા માટે ઓક્સિડેશન પ્રતિક્રિયાઓ પરના કાર્યો માટે"
રસાયણશાસ્ત્ર 2000 નો નોબલ પુરસ્કાર
એલન જે. હેગર , એલન જી. મેકડીઆર્મિડ અને હૈદકી શિરાકાવા "વાહક પોલિમર્સની શોધ અને વિકાસ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1999
અહમદ એચ. ઝેવૈલે "ફેમટોસેકંડ સ્પેક્ટ્રોસ્કોપીનો ઉપયોગ કરીને રાસાયણિક પ્રતિક્રિયાઓના સંક્રમણ સ્થિતિના તેમના અભ્યાસ માટે"
કેમિસ્ટ્રી 1998 માં નોબલ પુરસ્કાર
વોલ્ટર કોહન "ઘનતા-કાર્યાત્મક થિયરીના વિકાસ માટે"
જ્હોન એ. પોપલ "ક્વોન્ટમ કેમિસ્ટ્રીમાં કમ્પ્યુટેશનલ પદ્ધતિઓના વિકાસ માટે"
1997 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
એડોનોસિન ટ્રાઇફોસ્ફેટ (એટીપી) ના સંશ્લેષણ હેઠળના એન્ઝાઇમેટિક મિકેનિઝમના તેમના વિશ્લેષણ માટે પોલ ડી. બોયર અને જ્હોન ઇ. વૉકર "
આયન-પરિવહન એન્ઝાઇમ, ના +, કે + -ATPase ની પ્રથમ શોધ માટે જેન્સ સી. સ્કૂ "
1996 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
રોબર્ટ એફ. કર્લ જુનિયર , સર હેરોલ્ડ ડબ્લ્યુ. ક્રેટો અને રિચાર્ડ ઇ . સ્મેલી "ફોર ડીલવરી ઑફ ફ્લુરેન્સ"
1995 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
પૌલ જે. ક્રુટઝન , મારિયો જે. મોલિના અને એફ. શેરવુડ રોલેન્ડ "વાતાવરણીય રસાયણશાસ્ત્રમાં તેમના કામ માટે, ખાસ કરીને ઓઝોનની રચના અને વિઘટન સંબંધિત"
1994 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જ્યોર્જ એ. ઓલાહ "કાર્બોકેશન રસાયણશાસ્ત્રમાં તેમના યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1993
"ડીએનએ આધારિત રસાયણશાસ્ત્રની પદ્ધતિઓના વિકાસમાં યોગદાન માટે"
પોલિમેઝ ચેઇન રિએક્શન (પીસીઆર) પદ્ધતિની શોધ માટે કેરી બી. મુલિસ "
માઈકલ સ્મિથ "ઓલિગોન્યુક્લિઓટાઇડ-આધારિત, સાઇટ-નિર્દેશિત મ્યુટેજેનેસિસ અને પ્રોટીન અભ્યાસો માટે તેના વિકાસની સ્થાપનામાં તેમના મૂળભૂત યોગદાન માટે"
1992 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રુડોલ્ફ એ. માર્કસ "રાસાયણિક સિસ્ટમ્સમાં ઇલેક્ટ્રોન ટ્રાન્સફર પ્રતિક્રિયાઓના થિયરીમાં તેમના યોગદાન માટે"
1991 માં કેમિસ્ટ્રીમાં નોબલ પુરસ્કાર
રિચાર્ડ આર. અર્ન્સ્ટ "ઉચ્ચ રીઝોલ્યુશન પરમાણુ ચુંબકીય પ્રતિસાદ (એનએમઆર) સ્પેક્ટ્રોસ્કોપીની પદ્ધતિના વિકાસમાં તેમના યોગદાન માટે"
કેમિસ્ટ્રી 1990 માં નોબેલ પુરસ્કાર
એલિયાસ જેમ્સ કોરી "તેના સિદ્ધાંત અને કાર્બનિક સંશ્લેષણની કાર્યવાહીના વિકાસ માટે"
કેમિસ્ટ્રી 1989 માં નોબલ પુરસ્કાર
સિડની ઓલ્ટમેન અને થોમસ આર. સેચ "આરએનએના ઉત્પ્રેરક ગુણધર્મોની શોધ માટે"
કેમિસ્ટ્રી 1988 માં નોબેલ પુરસ્કાર
જોહાન ડેઇઝહોફ્ફર , રોબર્ટ હ્યુબર અને હાર્ટમટ મિશેલ "પ્રકાશસંશ્લેષણ પ્રતિક્રિયા કેન્દ્રની ત્રિ-પરિમાણીય માળખાના નિર્ધારણ માટે"
રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર 1987
ડોનાલ્ડ જે. ક્રેમ , જીન-મેરી લેહ્ન અને ચાર્લ્સ જે. પેડર્સન "તેમના વિકાસ અને ઉચ્ચ પસંદગીની રચના-વિશિષ્ટ ક્રિયાપ્રતિક્રિયાઓ સાથેના પરમાણુઓના ઉપયોગ માટે"
કેમિસ્ટ્રી 1986 માં નોબલ પુરસ્કાર
ડુડલી આર. હર્સચબાચ , યુઆન ટી. લી અને જ્હોન સી. પોલેની "રાસાયણિક પ્રારંભિક પ્રક્રિયાઓની ગતિશીલતાને લગતા તેમના યોગદાન માટે"
1985 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હર્બર્ટ એ. હ્યુપ્ટમેન અને જેરોમ કાર્લે "ક્રિસ્ટલ માળખાના નિર્ધારણ માટે સીધા પદ્ધતિઓના વિકાસમાં તેમની ઉત્કૃષ્ટ સિદ્ધિઓ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1984
રોબર્ટ બ્રુસ મેરિફિલ્ડ "નક્કર મેટ્રિક્સ પર રાસાયણિક સંશ્લેષણ માટે પદ્ધતિના વિકાસ માટે"
1983 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હેનરી ટેબે "ઇલેક્ટ્રોન ટ્રાન્સફર પ્રતિક્રિયાઓના મેકેનિઝમ પરના તેમના કાર્ય માટે, ખાસ કરીને મેટલ સંકુલમાં"
1982 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
એરોન ક્લુગ "ક્રિસ્ટલોગ્રાફિક ઇલેક્ટ્રોન માઇક્રોસ્કોપીના વિકાસ માટે અને બાયોલોજિકલી અગત્યના ન્યુક્લિયર એસિડ-પ્રોટીન સંકુલના તેના માળખાકીય વિશ્લેષણ માટે"
1981 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કેનીચી ફુકુઇ અને રોઆલ્ડ હોફમેન "તેમના સિદ્ધાંતો માટે, રાસાયણિક પ્રતિક્રિયાઓના અભ્યાસ માટે સ્વતંત્ર રીતે વિકસિત થયા હતા"
કેમિસ્ટ્રીમાં નોબેલ પુરસ્કાર 1980
પાઉલ બર્ગ "ન્યુક્લિક એસિડ્સની બાયોકેમિસ્ટ્રીના તેના મૂળભૂત અભ્યાસ માટે, ખાસ કરીને રિકોમ્બિનન્ટ-ડીએનએના સંદર્ભમાં"
વોલ્ટર ગિલ્બર્ટ અને ફ્રેડરિક સેંજર "ન્યુક્લિક એસિડ્સમાં બેઝ સિક્વન્સના નિર્ધારણ અંગેના તેમના યોગદાન માટે"
1979 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
હર્બર્ટ સી. બ્રાઉન અને જ્યોર્જ વિટીગ "બૉરોન અને ફોસ્ફરસ-સંયોજક સંયોજનોના ઉપયોગના તેમના વિકાસ માટે, અનુક્રમે, કાર્બનિક સંશ્લેષણમાં મહત્વપૂર્ણ ઘટકોમાં"
1978 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કેમોસમોટિક સિદ્ધાંતની રચના દ્વારા જૈવિક ઉર્જા પરિવહનની સમજણમાં તેમના યોગદાન બદલ પીટર ડી. મિશેલ "
1977 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ઇલિયા પ્રિગૉગિન "બિન સંતુલિત થર્મોડાયનેમિક્સમાં તેના યોગદાન માટે, ખાસ કરીને ડિસિપ્પીટીવ સ્ટ્રક્ચરની થિયરી"
1976 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલિયમ એન. લિપ્સકોમ્બ "રાસાયણિક બંધનની સમસ્યાઓને પ્રકાશિત કરતી બોરેનની રચના પરના તેમના અભ્યાસ માટે"
1975 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જ્હોન વૉર્કઅપ કોર્નફોર્થ "એન્ઝાઇમ-ઉત્પ્રેરિત પ્રતિક્રિયાઓના સ્ટીરિયોકેમિસ્ટ્રી પરના તેમના કાર્ય માટે"
વ્લાદિમીર પ્રિલોગ "કાર્બનિક પરમાણુ અને પ્રતિક્રિયાઓના સ્ટીરિયોકેમિસ્ટ્રીમાં સંશોધન માટે"
1974 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
પાઉલ જે. ફ્લોરી "તેના મૂળ સિધ્ધાંતો માટે, સૈદ્ધાંતિક અને પ્રાયોગિક બંને, મૅક્રોમોલ્યુકલ્સની ભૌતિક રસાયણશાસ્ત્રમાં"
1973 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
અર્નેસ્ટ ઓટો ફિશેર અને જીઓફ્રી વિલ્કિન્સન "તેમના અગ્રણી કાર્ય માટે, સ્વતંત્ર રીતે રજૂ કર્યું, એર્ગોમેટેમિકની રસાયણશાસ્ત્ર પર, જેને કહેવાતા સેન્ડવિચ સંયોજનો"
1972 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ક્રિશ્ચિયન બી. એન્ફિન્સન "રિબોન્યુક્લીઝ પરના તેમના કામ માટે, ખાસ કરીને એમિનો એસિડ અનુક્રમણિકા અને જીવવિજ્ઞાની સક્રિય રચના વચ્ચેના સંબંધને લગતા"
સ્ટેનફોર્ડ મૂર અને વિલિયમ એચ. સ્ટીન "રિઓનકુક્લીઝ અણુના સક્રિય કેન્દ્રના રાસાયણિક માળખા અને ઉત્પ્રેરક પ્રવૃત્તિ વચ્ચેનાં જોડાણની સમજણમાં તેમના યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1971
ગેરહાર્ડ હર્ઝબર્ગ "તેના પર ઇલેક્ટ્રોનિક માળખા અને અણુઓની ભૂમિતિ, ખાસ કરીને મુક્ત રેડિકલના જ્ઞાનમાં યોગદાન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1970
લ્યુઇસ એફ. લિલોઇર "તેમની શોધ માટે ખાંડ ન્યુક્લિયોટાઇડ્સ અને કાર્બોહાઇડ્રેટ્સના બાયોસિન્થેસિસમાં તેમની ભૂમિકા"
1969 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ડેરેક એચઆર બાર્ટન અને ઑડ હસેલ " રચનાના ખ્યાલના વિકાસમાં અને તેના રસાયણશાસ્ત્રમાં તેની રજૂઆત માટેના યોગદાન માટે"
1968 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
લાર્સ ઑન્સેસર "તેમના નામને લગતા પારસ્પરિક સંબંધોની શોધ માટે, જે અપ્રગટ પ્રક્રિયાઓની થર્મોડાયનેમિક્સ માટે મૂળભૂત છે."
1967 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
મેનફ્રેડ ઇજેન , રોનાલ્ડ જ્યોર્જ વેરેફોર્ડ નોરિશ અને જ્યોર્જ પોર્ટર "અત્યંત ઝડપી રાસાયણિક પ્રતિક્રિયાઓના અભ્યાસ માટે, ઊર્જાના ખૂબ ટૂંકા કઠોળ દ્વારા સંતુલનને ખલેલ પહોંચાડે છે"
1966 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રોબર્ટ એસ. મુલિકેન "રાસાયણિક બોન્ડ અને પરમાણુ ઓર્બિટલ પદ્ધતિ દ્વારા પરમાણુના ઇલેક્ટ્રોનિક માળખા અંગેના તેના મૂળભૂત કાર્ય માટે"
1965 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
રોબર્ટ બર્ન્સ વુડવર્ડ "કાર્બનિક સંશ્લેષણની આર્ટમાં તેમની ઉત્કૃષ્ટ સિદ્ધિઓ માટે"
1964 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ડોરોથી ક્રોફફૂટ હોજકિન "મહત્વપૂર્ણ બાયોકેમિકલ પદાર્થોના માળખાના એક્સ-રે તકનીકો દ્વારા તેના નિર્ણયો માટે"
1963 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કાર્લ ઝિગલર અને જિયુલિઓ નત્તા "કેમિસ્ટ્રી અને ઉચ્ચ પોલિમર્સની તકનીકમાં તેમની શોધ માટે"
1962 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
મેક્સ ફર્ડિનાન્ડ પેરુત્ઝ અને જ્હોન કેઉડરી કેન્ડ્રુ "ગ્લોબ્યુલર પ્રોટીનની રચનાઓના અભ્યાસ માટે"
રસાયણશાસ્ત્ર 1961 માં નોબલ પુરસ્કાર
મેલ્વિન કેલ્વિન "છોડમાં કાર્બન ડાયોક્સાઇડ એસિમિલેશન પર સંશોધન માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1960
વિલેર્ડ ફ્રેન્ક લિબી "પુરાતત્ત્વશાસ્ત્ર, ભૂસ્તરશાસ્ત્ર, ભૂસ્તરશાસ્ત્ર અને વિજ્ઞાનની અન્ય શાખાઓમાં વય નિર્ધારણ માટે કાર્બન -14 નો ઉપયોગ કરવાની તેમની પદ્ધતિ માટે"
1959 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જરોસ્લાવ હીરોવ્સ્કી "તેની શોધ અને વિશ્લેષણના પોલરાગ્રાફિક પદ્ધતિઓના વિકાસ માટે"
1958 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રેડરિક સેન્જર "પ્રોટીનની રચના પર તેના કામ માટે, ખાસ કરીને ઇન્સ્યુલિનની"
1957 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
લોર્ડ (એલેક્ઝાન્ડર આર.) ટોડ "ન્યુક્લિયોટાઈડ્સ અને ન્યુક્લિયોટાઇડ સહ-એન્ઝાઇમ્સ પરના તેમના કામ માટે"
1956 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
સર સિરિલ નોર્મન હિન્સેલવુડ અને નિકોલે નિકોલાવીચ સેમેનોવ "તેમના સંશોધન માટે રાસાયણિક પ્રતિક્રિયાઓની પદ્ધતિમાં"
1955 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
વિન્સેન્ટ ડુ વિગ્નેડ "બાયોકેમિકલી અગત્યના સલ્ફર સંયોજનો પરના તેમના કાર્ય માટે, ખાસ કરીને પોલિપેપ્ટાઇડ હોર્મોનના પ્રથમ સંશ્લેષણ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1954
લીનસ કાર્લ પૌલીંગ "રાસાયણિક બોન્ડની પ્રકૃતિમાં તેના સંશોધન માટે અને જટિલ પદાર્થોના માળખાની સ્પષ્ટતા માટે તેની અરજી"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1953
હર્મન સ્ટૌડીંગર "મેક્રોમોલેક્યુલર કેમિસ્ટ્રીના ક્ષેત્રમાં તેની શોધ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1952
આર્ચર જ્હોન પોર્ટર માર્ટિન અને રિચાર્ડ લોરેન્સ મિલીંગ્ટન સિંજ "પાર્ટીશન ક્રોમેટોગ્રાફીની શોધ માટે"
1951 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
એડવિન મેટિસન મેકમિલન અને ગ્લેન થિયોડોર સીબોર્ગ "ટ્રાન્સએરેનિયમ તત્વોના રસાયણશાસ્ત્રમાં તેમની શોધ માટે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1950
ઑટો પૌલ હર્મન ડાયલ્સ અને કર્ટ એલ્ડર "તેમની શોધ અને ડિયાન સંશ્લેષણના વિકાસ માટે"
1949 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલિયમ ફ્રાન્સિસ ગિયાક "રાસાયણિક થર્મોડાયનેમિક્સના ક્ષેત્રમાં તેમના યોગદાન માટે, ખાસ કરીને અત્યંત ઓછી તાપમાને પદાર્થોની વર્તણૂંક સંબંધિત"
1948 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એરેન વિલ્હેમ કૌરિન ટિસેલિયસ "ઇલેક્ટ્રોફોર્સિસ અને શોષણ વિશ્લેષણ અંગેના તેમના સંશોધન માટે, ખાસ કરીને સીરમ પ્રોટીનની જટિલ પ્રકૃતિ સંબંધિત તેની શોધ માટે"
1947 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
સર રોબર્ટ રોબિન્સન "જૈવિક મહત્વના છોડના ઉત્પાદનો અંગેની તેમની તપાસ માટે, ખાસ કરીને ઍલ્કલોઇડ્સ"
1946 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જેમ્સ બૅથેલર સુમનર "તેની શોધ માટે કે એન્ઝાઇમ્સ સ્ફટિકીકરણ કરી શકાય છે"
જ્હોન હોવર્ડ નોર્થ્રોપ અને વેન્ડેલ મેરિડિથ સ્ટેનલી "તેમના શુદ્ધ સ્વરૂપમાં એન્ઝાઇમ્સ અને વાયરસ પ્રોટીનની તૈયારી માટે"
1945 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
અર્તૂરી ઈલ્મારી ફ્યુટેનને "તેના સંશોધન અને શોધ માટે કૃષિ અને પોષણ રસાયણશાસ્ત્રમાં સંશોધન, ખાસ કરીને તેના ચારા સંરક્ષણ પદ્ધતિ માટે"
1944 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ઓટ્ટો હેન "ભારે ન્યુક્લિયાની ફિશશનની શોધ માટે"
1943 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
જ્યોર્જ ડે હેવેસી "રાસાયણિક પ્રક્રિયાઓના અભ્યાસમાં આઇસોટોપ્સના ઉપયોગ પરના તેના કામ માટેના ટ્રેસર્સ તરીકે"
1942 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1941 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1940 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
1939 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડોલ્ફ ફ્રેડરિચ જોહ્ન બ્યુએનનેટ્ટ "સેક્સ હોર્મોન્સ પરના તેમના કામ માટે"
લિયોપોલ્ડ રુઝિકા "પોલિમિથિલેન્સ અને ઉચ્ચ ટેપરિન્સ પરના તેમના કામ માટે"
1938 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રિચાર્ડ કુહ્ન "કેરોટીનોઇડ્સ અને વિટામિન્સ પરના તેમના કામ માટે"
1937 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કાર્બોહાઇડ્રેટ્સ અને વિટામિન સી પર તેની તપાસ માટે વોલ્ટર નોર્મન હોઉથ "
પાઉલ કેરર "કેરોટીનોઇડ્સ, ફ્લેવિન્સ અને વિટામિન્સ એ અને બી 2 પર તેમની તપાસ માટે"
1936 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
પેટ્રુસ (પીટર) જોસેફસ વિલ્હેમમસ ડબ્બી " દ્વિપકલ્પના ક્ષણો પર અને એક્સ-રે અને વાયુઓમાં ઇલેક્ટ્રોનના વિસર્જન પર તેની તપાસ દ્વારા પરમાણુ માળખાના અમારા જ્ઞાનમાં યોગદાન બદલ"
1935 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રેડેરિક Joliot અને ઇરેન જોલિઓટ-ક્યુરી "નવા કિરણોત્સર્ગી તત્વો તેમના સંશ્લેષણ માન્યતા માં"
1934 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
હેરોલ્ડ ક્લેટોન ઉરે "તેની શોધ માટે ભારે હાઇડ્રોજન"
1933 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. આ ઇનામ વિભાગના વિશિષ્ટ ભંડોળમાં મુખ્ય ફંડને ફાળવવામાં આવેલા 1/3 અને 2/3 સાથે પુરસ્કાર મની હતી.
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1932
ઇરવિંગ લેંગમુઇર "તેની શોધ અને સપાટીની રસાયણશાસ્ત્રમાં તપાસ માટે"
1931 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
કાર્લ બોશ અને ફ્રેડરિક બર્ગિયસ "રાસાયણિક ઉચ્ચ દબાણ પદ્ધતિઓના સંશોધન અને વિકાસમાં તેમના યોગદાનને માન્યતા આપતા"
1930 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હંસ ફિશર "તેના સંશોધન માટે હેમેઈન અને હરિતદ્રવ્યના બંધારણમાં અને ખાસ કરીને હેમેઈનના તેના સંશ્લેષણ માટે"
1929 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
આર્થર હાર્ડેન અને હંસ કાર્લ ઑગસ્ટ સિમોન વોન યુલર-ચેપ્પીન "ખાંડ અને આથોના ઉત્સેચકોની આથો પર તેમની તપાસ માટે"
1928 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડોલ્ફ ઓટ્ટો રેઇનહોલ્ડ વિન્ડૉસ " સ્ટર્ોલ્સના બંધારણમાં તેમના સંશોધન દ્વારા અને વિટામિન્સ સાથેના તેમના જોડાણ દ્વારા પ્રસ્તુત સેવાઓ માટે"
1927 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
બાયલ એસિડ્સ અને સંબંધિત પદાર્થોના બંધારણની તેની તપાસ માટે હેનરિચ ઑટો વાઇલેન્ડ "
1926 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
(થિયોડોર) સ્વેર્ડબર્ગ " વિખેરવાની વ્યવસ્થા પરના તેમના કાર્ય માટે"
1925 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
રિચાર્ડ એડોલ્ફ ઝ્સિગ્મોન્ડી "કોલોઇડ સોલ્યુશન્સની વિષમ પ્રકૃતિના તેમના નિદર્શન માટે અને તેણે ઉપયોગમાં લેવાતી પદ્ધતિઓ માટે, જે ત્યારથી આધુનિક કોલોઇડ રસાયણશાસ્ત્રમાં મૂળભૂત બની ગયું છે"
1924 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1923 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
કાર્બનિક પદાર્થોના સૂક્ષ્મ વિશ્લેષણની પદ્ધતિની શોધ માટે ફ્રિટ્ઝ પ્રિગ "
1922 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ફ્રાન્સિસ વિલિયમ એસ્ટોન "તેની શોધ માટે, તેના સામૂહિક વર્ણપટ્ટાકૃતિ દ્વારા, આઇસોટોપ્સની, મોટી સંખ્યામાં બિન-કિરણોત્સર્ગી તત્વોમાં, અને સંપૂર્ણ-અંકુશના નિયમની તેમની પ્રતિજ્ઞા માટે"
1921 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ફ્રેડરિક સોડ્ડી "કિરણોત્સર્ગી પદાર્થોના રસાયણશાસ્ત્રના અમારા જ્ઞાનમાં, અને આઇસોટોપ્સના મૂળ અને પ્રકૃતિમાં તેની તપાસમાં યોગદાન બદલ"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1920
વોલ્થર હર્મન નર્નેસ્ટ "થર્મોકેમિસ્ટ્રીમાં તેમના કામની ઓળખમાં"
1919 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1918 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
ફ્રિટ્ઝ હેબર "તેના તત્વોમાંથી એમોનિયાના સંશ્લેષણ માટે"
1917 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
રસાયણશાસ્ત્ર 1916 નો નોબલ પુરસ્કાર
આ વર્ષે નોબલ પુરસ્કાર એનાયત કરાયો નથી. ઇનામના પૈસા આ ઇનામ વિભાગના વિશેષ ફંડને ફાળવવામાં આવ્યા હતા.
1915 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
રિચાર્ડ માર્ટિન વિલ્સ્ટટર "છોડના રંગદ્રવ્યો પર તેના સંશોધન માટે, ખાસ કરીને હરિતદ્રવ્ય"
1914 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
થિયોડોર વિલિયમ રિચાર્ડ્સ "રાસાયણિક ઘટકોની મોટી સંખ્યાના પરમાણુ વજનના તેના ચોક્કસ નિર્ણયોને માન્યતા આપતા"
1913 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
આલ્ફ્રેડ વર્નર "પરમાણુઓના અણુઓના જોડાણ પરના તેમના કાર્યને માન્યતા આપીને તેમણે અગાઉની તપાસ પર નવો પ્રકાશ ફેંક્યો હતો અને ખાસ કરીને અકાર્બનિક રસાયણશાસ્ત્રમાં સંશોધનના નવા ક્ષેત્રો ખોલ્યા હતા."
1912 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિક્ટર ગ્રિગાર્ડ "કહેવાતા ગ્રિગાર્ડ રીજેન્ટની શોધ માટે, જે તાજેતરના વર્ષોમાં કાર્બનિક રસાયણશાસ્ત્રની પ્રગતિને ખૂબ જ અદ્યતન કરે છે"
પાઉલ સબાટિઅર "ઉડી ગયેલી ધાતુઓની હાજરીમાં કાર્બનિક સંયોજનોને હાઇડ્રોજન કરતી પદ્ધતિ માટે, જેમાં તાજેતરના વર્ષોમાં કાર્બનિક રસાયણશાસ્ત્રની પ્રગતિ ખૂબ જ અદ્યતન થઈ છે"
1911 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
મેરી ક્યુરી, ને સ્ક્લોડોડ્સ્કા " રેડીયમના એકાંત દ્વારા અને રસાયણના એકાંત દ્વારા અને આ નોંધપાત્ર તત્વના સંયોજનોના અભ્યાસ દ્વારા રાસાયિયમ અને પોલોનીયમની શોધ દ્વારા રસાયણશાસ્ત્રની પ્રગતિ માટે તેમની સેવાઓની માન્યતામાં"
1910 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
ઑટો વૅલૅચ "એલિસાયક્લિક સંયોજનોના ક્ષેત્રે તેના અગ્રણી કાર્ય દ્વારા કાર્બનિક રસાયણશાસ્ત્ર અને રાસાયણિક ઉદ્યોગે તેમની સેવાઓને માન્યતા આપીને"
1909 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
વિલ્હેમ ઓસ્ટવાલ્ડ " કેટાલિસિસ પરના તેમના કાર્યને માન્યતા આપવા અને રાસાયણિક સમતુલાને નિયંત્રિત કરતી મૂળભૂત સિદ્ધાંતોમાં તેમની તપાસ માટે અને પ્રતિક્રિયાના દર"
1908 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
અર્નેસ્ટ રધરફર્ડ "તત્વોના વિઘટનમાં તેની તપાસ માટે અને કિરણોત્સર્ગી પદાર્થોની રસાયણશાસ્ત્ર"
1907 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
એડવર્ડ બ્યુકેનર "તેમના બાયોકેમિકલ સંશોધનો અને સેલ-ફ્રી આથોની શોધ માટે"
1906 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
હેનરી મોઇઝન "તેમની તપાસ અને તત્વ ફ્લોરોઇનની અલગતા અને ઇલેક્ટ્રિક ભઠ્ઠીના વિજ્ઞાનની સેવામાં તેને અપનાવવા બદલ તેમની દ્વારા આપવામાં આવતી મોટી સેવાઓને માન્યતા આપતા"
1905 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
જહોન ફ્રેડરિક વિલ્હેમ એડોલ્ફ વોન બેયર "કાર્બનિક રંગો અને હાઇડ્રોરોમેટિક સંયોજનો પરના તેમના કાર્ય દ્વારા કાર્બનિક રસાયણશાસ્ત્ર અને રાસાયણિક ઉદ્યોગોના વિકાસમાં તેમની સેવાઓને માન્યતા આપતા"
1904 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
સર વિલિયમ રામસેએ "હવાના નિષ્ક્રિય વાયુઓના તત્વોની શોધમાં તેમની સેવાઓને માન્યતા આપી અને સમયાંતરે તેમની સ્થિતીનું નિર્ધારણ કર્યું."
1903 માં રસાયણશાસ્ત્રમાં નોબલ પુરસ્કાર
સ્વેન્ટે ઑગસ્ટ એરેનિયિયસ "અસાધારણ સેવાઓની માન્યતામાં તેમણે રસાયણશાસ્ત્રના વિકાસને તેના વિસર્જનના વિદ્યુતવિજ્ઞાન સિદ્ધાંત દ્વારા પ્રદાન કર્યું છે"
રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર 1902
હર્મન એમિલ ફિશર "તેમણે ખાંડ અને શુદ્ધ સંશ્લેષણ પરના તેમના કાર્ય દ્વારા અસાધારણ સેવાઓને માન્યતા આપતા"
1901 માં રસાયણશાસ્ત્રમાં નોબેલ પુરસ્કાર
જેકબસ હેન્રીકસ વેન ટી હોફ "અસાધારણ સેવાઓને માન્યતા આપીને, રાસાયણિક ગતિશીલતાના નિયમો અને ઉકેલોમાં ઓસમોટિક દબાણના અધ્યયન દ્વારા તેને રજૂ કરે છે
Saturday, 8 September 2018
USEFULL THEORY FOR B.SC
RESONANCE
In a Chemistry resonance is
way of describing delocalized electrons within certain molecules or polyatomic ions where the bonding cannot be expressed by one single Lewis structure. A molecule or ion with such delocalized electrons is represented by several contributing structures.canonical structures, or, in older works or translations, mesomers), which collectively constitute a resonance hybrid.
DELOCALIZED ELECTRON
in resonance structures, the electrons are able to move to help stabilize the molecule. This movement of the electrons is called delocalization.
HISTORY OF RESONANCE
The concept first appeared in 1899 in Johannes Thiele's "Partial Valence Hypothesis" to explain the unusual stability of benzene which would not be expected from August Kekulé's structure proposed in 1865 with alternating single and double bonds.
The resonance proposal also helped explain the number of isomers of benzene derivatives. For example, Kekulé's structure would predict four dibromobenzene isomers, including two ortho isomers with the brominated carbons joined by either a single or a double bond. In reality there are only three dibromobenzene isomers and only one is ortho, in agreement with the idea that there is only type of carbon-carbon bond, intermediate between a single and a double bond.
The mechanism of resonance was introduced into quantum mechanics by Werner Heisenberg in 1926 in a discussion of the quantum states of the helium atom. He compared the structure of the helium atom with the classical system of resonating coupled harmonic oscillators.
In the classical system, the coupling produces two modes, one of which is lower in frequencythan either of the uncoupled vibrations; quantum mechanically, this lower frequency is interpreted as a lower energy. Linus Pauling used this mechanism to explain the partial valence of molecules in 1928, and developed it further in a series of papers in 1931-1933
The alternative term mesomerism popular in German and French publications with the same meaning was introduced by C. K. Ingold in 1938, but did not catch on in the English literature. The current concept of mesomeric effect has taken on a related but different meaning. The double headed arrow was introduced by the German chemist Fritz Arndt who preferred the German phrase zwischenstufe or intermediate stage.
In the Soviet Union, resonance theory – especially as developed by Pauling – was attacked in the early 1950s as being contrary to the Marxist principles of dialectical materialism, and in June 1951 the Soviet Academy of Sciences under the leadership of Alexander Nesmeyanov convened a conference on the chemical structure of organic compounds, attended by 400 physicists, chemists, and philosophers, where "the pseudo-scientific essence of the theory of resonance was exposed and unmasked".
In a Chemistry resonance is
way of describing delocalized electrons within certain molecules or polyatomic ions where the bonding cannot be expressed by one single Lewis structure. A molecule or ion with such delocalized electrons is represented by several contributing structures.canonical structures, or, in older works or translations, mesomers), which collectively constitute a resonance hybrid.
DELOCALIZED ELECTRON
in resonance structures, the electrons are able to move to help stabilize the molecule. This movement of the electrons is called delocalization.
HISTORY OF RESONANCE
The concept first appeared in 1899 in Johannes Thiele's "Partial Valence Hypothesis" to explain the unusual stability of benzene which would not be expected from August Kekulé's structure proposed in 1865 with alternating single and double bonds.
The resonance proposal also helped explain the number of isomers of benzene derivatives. For example, Kekulé's structure would predict four dibromobenzene isomers, including two ortho isomers with the brominated carbons joined by either a single or a double bond. In reality there are only three dibromobenzene isomers and only one is ortho, in agreement with the idea that there is only type of carbon-carbon bond, intermediate between a single and a double bond.
The mechanism of resonance was introduced into quantum mechanics by Werner Heisenberg in 1926 in a discussion of the quantum states of the helium atom. He compared the structure of the helium atom with the classical system of resonating coupled harmonic oscillators.
In the classical system, the coupling produces two modes, one of which is lower in frequencythan either of the uncoupled vibrations; quantum mechanically, this lower frequency is interpreted as a lower energy. Linus Pauling used this mechanism to explain the partial valence of molecules in 1928, and developed it further in a series of papers in 1931-1933
The alternative term mesomerism popular in German and French publications with the same meaning was introduced by C. K. Ingold in 1938, but did not catch on in the English literature. The current concept of mesomeric effect has taken on a related but different meaning. The double headed arrow was introduced by the German chemist Fritz Arndt who preferred the German phrase zwischenstufe or intermediate stage.
In the Soviet Union, resonance theory – especially as developed by Pauling – was attacked in the early 1950s as being contrary to the Marxist principles of dialectical materialism, and in June 1951 the Soviet Academy of Sciences under the leadership of Alexander Nesmeyanov convened a conference on the chemical structure of organic compounds, attended by 400 physicists, chemists, and philosophers, where "the pseudo-scientific essence of the theory of resonance was exposed and unmasked".
USEFULL NOTES
*#Useful_Information#*
1. What is the chemical name of Marble?
- *Calcium carbonate (CaCO3)*
2. What is the chemical name of acid?
- *Acaraj (3HCL + HNO3)*
3. What is the chemical name of Heavy Water?
- *Deuterium oxide (D2O)*
4. What is the chemical name of sugar?
- *Sucrose (C12H22O11)*
5. What is the chemical name of Marsh Gas?
- *Methane (CH4)*
6. What is the chemical name of Hypo?
- *Sodium thiosulfate - (Na2S2O3.5H2O)*
7. What is the chemical name of Laughing Gas?
- *nitrous oxide (N2O)*
8. What is the chemical name of Bleaching Powder?
- *Calcium hypochlorite (CaOcl2)*
9. What is the chemical name of sand?
- *Silicon oxide (SiO2)*
10. What is the Chemical Name of China White?
- *Zinc Oxide (ZnO)*
11. What is the chemical name of Alcohol?
- *Ethyl alcohol (C2H5OH)*
12. What is the chemical name of Caustic Soda?
- *Sodium Hydroxide (NaOH)*
13. What is the chemical name of Washing Soda?
- *Sodium carbonate (Na2Co3.10H2O)*
14. What is the chemical name of Plaster of Paris?
- *Calcium Sulphate Half Hydrate (CaSo4) 2 H2O*
15. What is the chemical name of Chile Saltpetre?
- *Sodium Nitrate (NaNO3)*
16. What is the chemical name of Suhaga?
- *Borax (Na2B4O7.10H2O)*
17. What is the chemical name of alum? - *Potassium Aluminum Sulphate (K2SO4Al2 (SO4) 3 24H2O)*
18. What is the chemical name of Blue Vitriol or Tutiya?
- *Copper sulfate (CuSO4.7H2O)*
19. - What is the chemical name of Dry Ice?
- *Solid carbon dioxide (CO2)*
20. What is the chemical name of Gypsum?
- *Calcium sulphate (CaSo4.2H2O)*
21. - What is the chemical name of White Vitriol?
- *Zinc Sulphate (ZnSO4)*
22. - What is the chemical name of Green Vitriol?
- *Ferrous sulphate FeSO4. 7H2O)*
23. What is the chemical name of bud lime?
- *Calcium oxide (CaO)*
24. What is the chemical name of cinabar?
- *Mercurial sulphide (HgS)*
25. What is the chemical name of Shore's acid?
- *Nitric acid - Nitric acid (HNO3)*
26. What is the chemical name of Salt acid?
- *Hydrochloric Acid (HCl)*
27. What is the chemical name of Nushadir salt?
- *Ammonium chloride (NH4Cl)*
28. What is the chemical name of Slaked Lime?
- *Calcium hydroxide (Ca (OH 2)*
29. What is the chemical name of sulfur acid?
- *Sulfuric acid (H2SO4)*
30. What is the chemical name of white potash?
- *Potassium chlorate (KclO3)*
31. What is the chemical name of globulin salts?
- *Sodium Sulphate (Na2SO4.10H2O)*
32. What is the chemical name of the caustic Potash?
- *Petitium High Droxide (KOH)*
33. - What is the chemical name of salt cake?
- *Sodium Sulphate (Na2SO4)*
34. What is the chemical name of Galena?
- *Lead sulphide (PbS)*
35. What is the chemical name of Common Salt?
- *Sodium Chloride (NaCl)*
36. What is the chemical name of T.N?
- *Tri-Nitrotolvin (C6H2CH3 (NO2) 3)*
37. What is the chemical name of Edible Soda?
- *Sodium bicarbonate (NaHCO3)*
38. What is the chemical name of Sora (Saltpetre)?
- *Potassium Nitrate (KNO3)*
Thursday, 22 February 2018
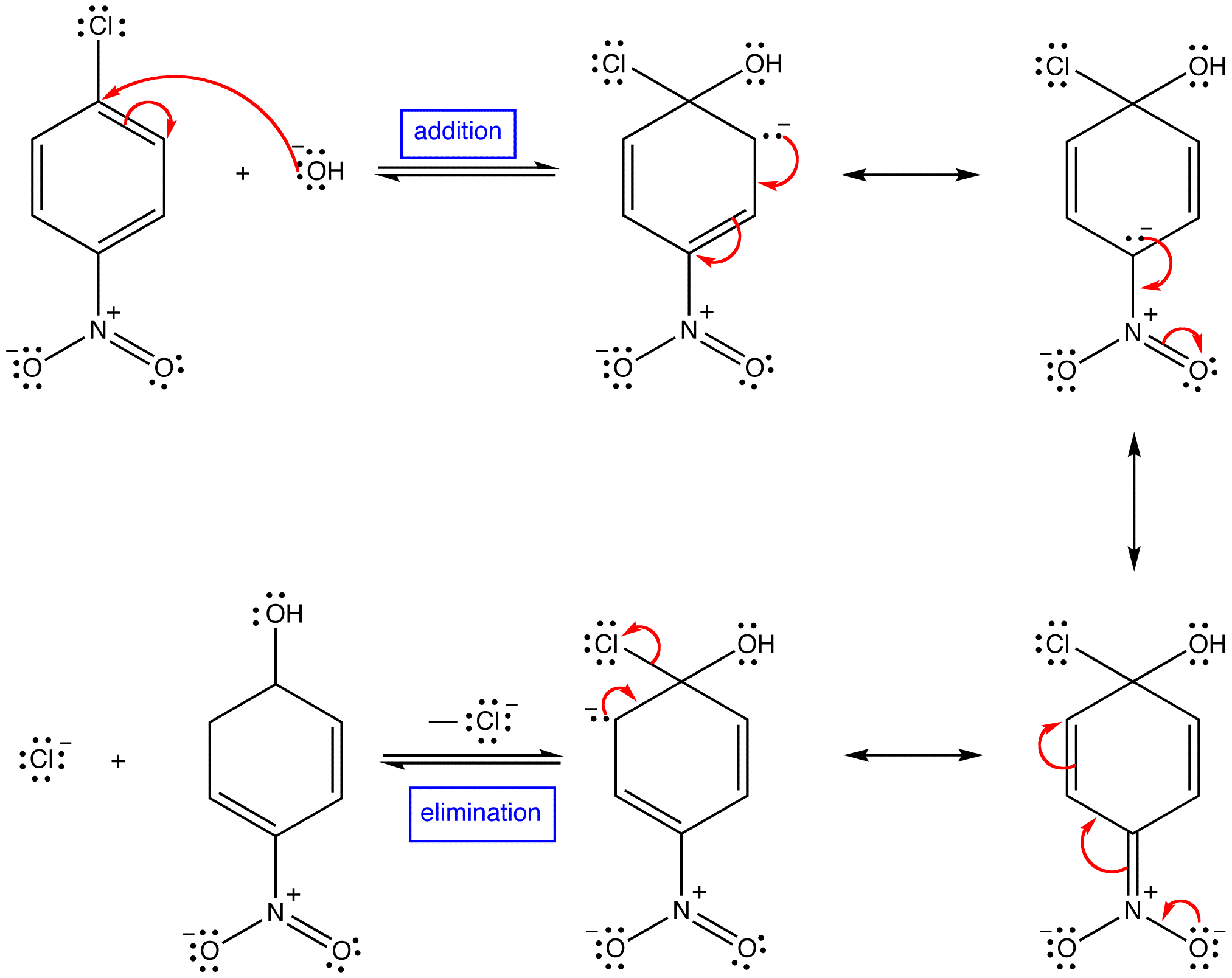
Organic reaction
Organic reactions are chemical reactions involving organic compounds.[1][2][3] The basic organic chemistryreaction types are addition reactions, elimination reactions, substitution reactions, pericyclic reactions, rearrangement reactions, photochemical reactions and redox reactions. In organic synthesis, organic reactions are used in the construction of new organic molecules. The production of many man-made chemicals such as drugs, plastics, food additives, fabrics depend on organic reactions.
The oldest organic reactions are combustion of organic fuels and saponification of fats to make soap. Modern organic chemistry starts with the Wöhler synthesis in 1828. In the history of the Nobel Prize in Chemistryawards have been given for the invention of specific organic reactions such as the Grignard reaction in 1912, the Diels-Alder reaction in 1950, the Wittig reaction in 1979 and olefin metathesis in 2005.
Monday, 19 February 2018
Organic reactions by mechanism
There is no limit to the number of possible organic reactions and mechanisms.[5][6] However, certain general patterns are observed that can be used to describe many common or useful reactions. Each reaction has a stepwise reaction mechanism that explains how it happens, although this detailed description of steps is not always clear from a list of reactants alone. Organic reactions can be organized into several basic types. Some reactions fit into more than one category. For example, some substitution reactions follow an addition-elimination pathway. This overview isn't intended to include every single organic reaction. Rather, it is intended to cover the basic reactions
Radical reaction
.gif?revision=1&size=bestfit&width=316&height=115)
 The Bromine Radical will go on and attack the LESS SUBSTITUTED carbon of the alkene. This is because after the bromine radical attacked the alkene a carbon radical will be formed. A carbon radical is more stable when it is at a more substituted carbon due to induction and hyperconjugation. Thus, the radical will be formed at the more substituted carbon, while the bromine is bonded to the less substituted carbon. After a carbon radical is formed, it will go on and attack the hydrogen of a HBr, which a bromine radical will be formed again.
The Bromine Radical will go on and attack the LESS SUBSTITUTED carbon of the alkene. This is because after the bromine radical attacked the alkene a carbon radical will be formed. A carbon radical is more stable when it is at a more substituted carbon due to induction and hyperconjugation. Thus, the radical will be formed at the more substituted carbon, while the bromine is bonded to the less substituted carbon. After a carbon radical is formed, it will go on and attack the hydrogen of a HBr, which a bromine radical will be formed again.
Elimination reaction
Addition reaction
An addition reaction, in organic chemistry, is in its simplest terms an organic reaction where two or more molecules combine to form a larger one (the adduct)
Addition reactions are limited to chemical compounds that have multiple bonds, such as molecules with carbon–carbon double bonds (alkenes), or with triple bonds (alkynes). Molecules containing carbon—heterodouble bonds like carbonyl (C=O) groups, or imine (C=N) groups, can undergo addition, as they too have double-bond character.
An addition reaction is the reverse of an elimination reaction. For instance, the hydration of an alkene to an alcohol is reversed by dehydration.
There are two main types of polar addition reactions: electrophilic addition and nucleophilic addition. Two non-polar addition reactions exist as well, called free-radical addition and cycloadditions. Addition reactions are also encountered in polymerizations and called addition polymerization.
Addition-elimination reaction
In the related addition-elimination reaction an addition reaction is followed by an elimination reaction. In the majority of reactions it involves addition of nucleophiles to carbonyl compounds in what is called nucleophilic acyl substitution.[3]
Other addition-elimination reactions are the reaction of an aliphatic amine to an imine and an aromatic amine to a Schiff base in alkylimino-de-oxo-bisubstitution. The hydrolysis of nitriles to carboxylic acids is also a form of addition-elimination.
1. The overall mechanism of an addition-elimination reaction is known as an addition-elimination mechanism.
2. Some nucleophilic aromaticsubstitution reactions occur via a two-step mechanism in which the first step, by definition, is an addition and the second step an elimination. The overall mechanism is known as an addition-elimination mechanism.
eg:

mechanism:

Sub types of addition reaction
Electrophilic addition
nucleophilic addition
Radical addition
Electrophilic addition
In organic chemistry, an electrophilic addition reaction is an addition reaction where, in a chemical compound, a π bond is broken and two new σ bonds are formed. The substrate of an electrophilic addition reaction must have a double bond or triple bond.[1]
The driving force for this reaction is the formation of an electrophile X+ that forms a covalent bond with an electron-rich unsaturated C=C bond. The positive charge on X is transferred to the carbon-carbon bond, forming a carbocation during the formation of the C-X bond.
In step 2 of an electrophilic addition, the positively charged intermediate combines with (Y) that is electron-rich and usually an anion to form the second covalent bond.
Step 2 is the same nucleophilic attack process found in an SN1 reaction. The exact nature of the electrophile and the nature of the positively charged intermediate are not always clear and depend on reactants and reaction conditions.
In all asymmetric addition reactions to carbon, regioselectivity is important and often determined by Markovnikov's rule. Organoborane compounds give anti-Markovnikov additions. Electrophilic attack to an aromatic system results in electrophilic aromatic substitution rather than an addition reaction.
Typical electrophilic additions to alkenes with reagents are:
- dihalo addition reactions: X2
- Hydrohalogenations: HX
- Hydration reactions: H2O
- Hydrogenations: H2
- Oxymercuration reactions: mercuric acetate, water
- Hydroboration-oxidation reactions: diborane
- the Prins reaction: formaldehyde, water
Nucleophilic addition
In organic chemistry, a nucleophilic addition reaction is an addition reaction where a chemical compound with an electron-deficient or electrophilic double or triple bond, a π bond, reacts with electron-rich reactant, termed a nucleophile, with disappearance of the double bond and creation of two new single, or σ, bonds. The reactions are involved in the biological synthesis of compounds in the metabolism of every living organism, and are used by chemists in academia and industries such as pharmaceuticals to prepare most new complex organic chemicals, and so are central to organic chemistry. Addition reactions require the presence of groups with multiple bonds in the electrophile: carbon–heteroatom multiple bonds as in carbonyls, imines, and nitriles, or carbon–carbon double or triple bonds.
Addition to carbon–heteroatom double bondsEdit
Nucleophilic addition reactions of nucleophiles with electrophilic double or triple bond (π bonds) create a new carbon center with two additional single, or σ, bonds.[1] Addition of a nucleophile to carbon–heteroatom double or triple bonds such as >C=O or -C
=N show great variety. These types of bonds are polar(have a large difference in electronegativity between the two atoms); consequently, their carbon atoms carries a partial positive charge. This makes the molecule an electrophile, and the carbon atom the electrophilic center; this atom is the primary target for the nucleophile. Chemists have developed a geometric system to describe the approach of the nucleophile to the electrophilic center, using two angles, the Bürgi–Dunitz and the Flippin–Lodge angles after scientists that first studied and described them.[2][3][4]
=N show great variety. These types of bonds are polar(have a large difference in electronegativity between the two atoms); consequently, their carbon atoms carries a partial positive charge. This makes the molecule an electrophile, and the carbon atom the electrophilic center; this atom is the primary target for the nucleophile. Chemists have developed a geometric system to describe the approach of the nucleophile to the electrophilic center, using two angles, the Bürgi–Dunitz and the Flippin–Lodge angles after scientists that first studied and described them.[2][3][4]
This type of reaction is also called a 1,2 nucleophilic addition. The stereochemistry of this type of nucleophilic attack is not an issue, when both alkyl substituents are dissimilar and there are not any other controlling issues such as chelation with a Lewis acid, the reaction product is a racemate. Addition reactions of this type are numerous. When the addition reaction is accompanied by an elimination the reaction type is nucleophilic acyl substitution or an addition-elimination reaction.
Addition to Carbonyl groupsEdit
With a carbonyl compound as an electrophile, the nucleophile can be:[1]
- water in hydration to a geminal diol (hydrate)
- an alcohol in acetalisation to an acetal
- a hydride in reduction to an alcohol
- an amine with formaldehyde and a carbonyl compound in the Mannich reaction
- an enolate ion in an aldol reaction or Baylis–Hillman reaction
- an organometallic nucleophile in the Grignard reactionor the related Barbier reaction or a Reformatskii reaction
- ylides such as a Wittig reagent or the Corey–Chaykovsky reagent or α-silyl carbanions in the Peterson olefination
- a phosphonate carbanion in the Horner–Wadsworth–Emmons reaction
- a pyridine zwitterion in the Hammick reaction
- an acetylide in alkynylation reactions.
- a cyanide ion in cyanohydrin reactions
In many nucleophilic reactions, addition to the carbonyl group is very important. In some cases, the C=O double bond is reduced to a C-O single bond when the nucleophile bonds with carbon. For example, in the cyanohydrin reaction a cyanide ion forms a C-C bond by breaking the carbonyl's double bond to form a cyanohydrin.
Addition to NitrilesEdit
- hydrolysis of a nitrile to form an amide or a carboxylic acid
- organozinc nucleophiles in the Blaise reaction
- alcohols in the Pinner reaction.
- the (same) nitrile α-carbon in the Thorpe reaction. The intramolecular version is called the Thorpe–Ziegler reaction.
- Grignard reagents to form imines.[5] The route affords ketones following hydrolysis[6] or primary aminesfollowing imine reduction.[7]
Addition to carbon–carbon double bondsEdit
The driving force for the addition to alkenes is the formation of a nucleophile X− that forms a covalent bond with an electron-poor unsaturated system -C=C- (step 1). The negative charge on X is transferred to the carbon – carbon bond.[1]
In step 2 the negatively charged carbanion combines with (Y) that is electron-poor to form the second covalent bond. Ordinary alkenes are not susceptible to a nucleophilic attack (apolar bond). Styrene reacts in toluene with sodium to 1,3-diphenylpropane [8] through the intermediate carbanion:
Another exception to the rule is found in the Varrentrapp reaction. Fullerenes have unusual double bond reactivity and additions such has the Bingel reaction are more frequent. When X is a carbonyl group like C=O or COOR or a cyanide group (CN), the reaction type is a conjugate addition reaction. The substituent X helps to stabilize the negative charge on the carbon atom by its inductive effect. In addition when Y-Z is an active hydrogen compound the reaction is known as a Michael reaction. Perfluorinated alkenes (alkenes that have all hydrogens replaced by fluorine) are highly prone to nucleophilic addition, for example by fluoride ion from caesium fluoride or silver(I) fluoride to give a perfluoroalkyl anion.
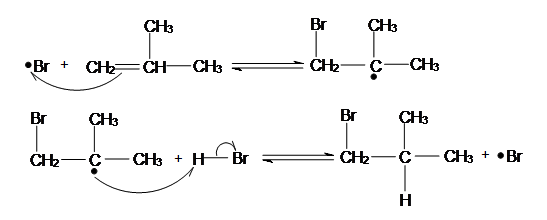
Radical reaction
Protons and other electrophiles are not the only reactive species that initiate addition reactions to carbon-carbon double bonds. Curiously, this first became evident as a result of conflicting reports concerning the regioselectivity of HBr additions. As noted earlier, the acid-induced addition of HBr to 1-butene gave predominantly 2-bromobutane, the Markovnikov Rule product. However, in some early experiments in which peroxide contaminated reactants were used, 1-bromobutane was the chief product. Further study showed that an alternative radical chain-reaction, initiated by peroxides, was responsible for the anti-Markovnikov product. This is shown by the following equations.
The weak O–O bond of a peroxide initiator is broken homolytically by thermal or hight energy. The resulting alkoxy radical then abstracts a hydrogen atom from HBr in a strongly exothermic reaction. Once a bromine atom is formed it adds to the π-bond of the alkene in the first step of a chain reaction. This addition is regioselective, giving the more stable carbon radical as an intermediate. The second step is carbon radical abstraction of another hydrogen from HBr, generating the anti-Markovnikov alkyl bromide and a new bromine atom. Each of the steps in this chain reaction is exothermic, so once started the process continues until radicals are lost to termination events.
This free radical chain addition competes very favorably with the slower ionic addition of HBr described earlier, especially in non-polar solvents. It is important to note, however, that HBr is unique in this respect. The radical addition process is unfavorable for HCl and HI because one of the chain steps becomes endothermic (the second for HCl & the first for HI).
Other radical addition reactions to alkenes have been observed, one example being the peroxide induced addition of carbon tetrachloride shown in the following equation
| RCH=CH2 + CCl4 (peroxide initiator) —> RCHClCH2CCl3 |
The best known and most important use of free radical addition to alkenes is probably polymerization. Since the addition of carbon radicals to double bonds is energetically favorable, concentrated solutions of alkenes are prone to radical-initiated polymerization, as illustrated for propene by the following equation. The blue colored R-group represents an initiating radical species or a growing polymer chain; the propene monomers are colored maroon. The addition always occurs so that the more stable radical intermediate is formed.
RCH2(CH3)CH· + CH3CH=CH2 —>RCH2(CH3)CH-CH2(CH3)CH· + CH3CH=CH2 —>RCH2(CH3)CHCH2(CH3)CH-CH2(CH3)CH· —> etc.
Anti-Markovnikov rule describes the regiochemistry where the substituent is bonded to a less substituted carbon, rather than the more substitued carbon. This process is quite unusual, as carboncations which are commonly formed during alkene, or alkyne reactions tend to favor the more substitued carbon. This is because substituted carbocation allow more hyperconjugation and indution to happen, making the carbocation more stable.
Introduction
This process was first explained by Morris Selig Karasch in his paper: 'The Addition of Hydrogen Bromide to Allyl Bromide' in 1933.1 Examples of Anti-Markovnikov includes Hydroboration-Oxidation and Radical Addition of HBr. A free radical is any chemical substance with unpaired electron. The more substituents the carbon is connected to, the more substituted is that carbon. For example: Tertiary carbon (most substituted), Secondary carbon (medium substituted), primary carbon (least substituted)
Anti-Markovnikov Radical Addition of Haloalkane can ONLY happen to HBr and there MUST be presence of Hydrogen Peroxide (H2O2). Hydrogen Peroxide is essential for this process, as it is the chemical which starts off the chain reaction in the initiation step. HI and HCl cannot be used in radical reactions, because in their radical reaction one of the radical reaction steps: Initiation is Endothermic, as recalled from Chem 118A, this means the reaction is unfavorable. To demonstrate the anti-Markovnikov regiochemistry, I will use 2-Methylprop-1-ene as an example below:
Initiation Steps
.gif?revision=1&size=bestfit&width=316&height=115)
Hydrogen Peroxide is an unstable molecule, if we heat it, or shine it with sunlight, two free radicals of OH will be formed. These OH radicals will go on and attack HBr, which will take the Hydrogen and create a Bromine radical. Hydrogen radical do not form as they tend to be extremely unstable with only one electron, thus bromine radical which is more stable will be readily formed.
Propagation Steps
 The Bromine Radical will go on and attack the LESS SUBSTITUTED carbon of the alkene. This is because after the bromine radical attacked the alkene a carbon radical will be formed. A carbon radical is more stable when it is at a more substituted carbon due to induction and hyperconjugation. Thus, the radical will be formed at the more substituted carbon, while the bromine is bonded to the less substituted carbon. After a carbon radical is formed, it will go on and attack the hydrogen of a HBr, which a bromine radical will be formed again.
The Bromine Radical will go on and attack the LESS SUBSTITUTED carbon of the alkene. This is because after the bromine radical attacked the alkene a carbon radical will be formed. A carbon radical is more stable when it is at a more substituted carbon due to induction and hyperconjugation. Thus, the radical will be formed at the more substituted carbon, while the bromine is bonded to the less substituted carbon. After a carbon radical is formed, it will go on and attack the hydrogen of a HBr, which a bromine radical will be formed again.Termination Steps
There are also Termination Steps, but we do not concern about the termination steps as they are just the radicals combining to create waste products. For example two bromine radical combined to give bromine. This radical addition of bromine to alkene by radical addition reaction will go on until all the alkene turns into bromoalkane, and this process will take some time to finish.
References
- K. Peter C. Vollhardt, Neil E. Schore; Organic Chemistry: Structure and Function Fifth Edition; W. H. Freeman and Campany, 2007
- Micheal Vokin; Nuffield Advance Chemistry Student's Book Forth Edition; Person Education Limited, 2004
Elimination reaction
An elimination reaction is a type of organic reaction in which two substituents are removed from a molecule in either a one or two-step mechanism.[2] The one-step mechanism is known as the E2 reaction, and the two-step mechanism is known as the E1 reaction. The numbers do not have to do with the number of steps in the mechanism, but rather the kinetics of the reaction, bimolecular and unimolecular respectively. In rare cases, for molecules possessing particularly poor leaving groups, a third type of reaction, E1CB, exists.
In most organic elimination reactions, at least one hydrogen is lost to form the double bond: the unsaturation of the molecule increases. It is also possible that a molecule undergoes reductive elimination, by which the valence of an atom in the molecule decreases by two, though this is more common in inorganic chemistry. An important class of elimination reactions is those involving alkyl halides, with good leaving groups, reacting with a Lewis base to form an alkene. Elimination may be considered the reverse of an addition reaction. When the substrate is asymmetric, regioselectivity is determined by Zaitsev's rule or through Hofmann elimination if the carbon with the most substituted hydrogen is inaccessible.
E2 mechanismEdit
During the 1920s, Sir Christopher Ingold proposed a model to explain a peculiar type of chemical reaction: the E2 mechanism. E2 stands for bimolecular elimination. The reaction involves a one-step mechanism in which carbon-hydrogen and carbon-halogen bonds break to form a double bond (C=C Pi bond).
The specifics of the reaction are as follows:
- E2 is a single step elimination, with a single transition state.
- It is typically undergone by primary substituted alkyl halides, but is possible with some secondary alkyl halides and other compounds.
- The reaction rate is second order, because it's influenced by both the alkyl halide and the base (bimolecular).
- Because the E2 mechanism results in the formation of a pi bond, the two leaving groups (often a hydrogen and a halogen) need to be antiperiplanar. An antiperiplanar transition state has staggeredconformation with lower energy than a synperiplanartransition state which is in eclipsed conformation with higher energy. The reaction mechanism involving staggered conformation is more favorable for E2 reactions (unlike E1 reactions).
- E2 typically uses a strong base. It must be strong enough to remove a weakly acidic hydrogen.
- In order for the pi bond to be created, the hybridizationof carbons needs to be lowered from sp3 to sp2.
- The C-H bond is weakened in the rate determining step and therefore a primary deuterium isotope effectmuch larger than 1 (commonly 2-6) is observed.
- E2 competes with the SN2 reaction mechanism if the base can also act as a nucleophile (true for many common bases).
An example of this type of reaction in scheme 1 is the reaction of isobutylbromide with potassium ethoxide in ethanol. The reaction products are isobutylene, ethanoland potassium bromide.
E1 mechanism
E1 is a model to explain a particular type of chemical elimination reaction. E1 stands for unimolecular elimination and has the following specificities.
- It is a two-step process of elimination: ionization and deprotonation.
- Ionization: the carbon-halogen bond breaks to give a carbocation intermediate.
- Deprotonation of the carbocation.
- E1 typically takes place with tertiary alkyl halides, but is possible with some secondary alkyl halides.
- The reaction rate is influenced only by the concentration of the alkyl halide because carbocation formation is the slowest step, aka the rate-determining step. Therefore, first-order kinetics apply (unimolecular).
- The reaction usually occurs in the complete absence of a base or the presence of only a weak base (acidic conditions and high temperature).
- E1 reactions are in competition with SN1 reactionsbecause they share a common carbocationic intermediate.
- A secondary deuterium isotope effect of slightly larger than 1 (commonly 1 - 1.5) is observed.
- There is no antiperiplanar requirement. An example is the pyrolysis of a certain sulfonate ester of menthol:
- Only reaction product A results from antiperiplanar elimination. The presence of product B is an indication that an E1 mechanism is occurring.[3]
- It is accompanied by carbocationic rearrangement reactions
An example in scheme 2 is the reaction of tert-butylbromide with potassium ethoxide in ethanol.
E1 eliminations happen with highly substituted alkyl halides for two main reasons.
- Highly substituted alkyl halides are bulky, limiting the room for the E2 one-step mechanism; therefore, the two-step E1 mechanism is favored.
- Highly substituted carbocations are more stable than methyl or primary substituted cations. Such stability gives time for the two-step E1 mechanism to occur.
- If SN1 and E1 pathways are competing, the E1 pathway can be favored by increasing the heat.
Specific features : 1 . Rearrangement possible 2 . Independent of concentration and basicity of base
SUBSTITUTION REACTION
Substitution reaction (also known as single displacement reaction or single substitution reaction)is a chemical reaction during which one functional group in a chemical compound is replaced by another functional group.[1][2] Substitution reactions are of prime importance in organic chemistry. Substitution reactions in organic chemistry are classified either as electrophilicor nucleophilic depending upon the reagent involved. There are other classifications as well that are mentioned below.
Organic substitution reactions are classified in several main organic reaction types depending on whether the reagent that brings about the substitution is considered an electrophile or a nucleophile, whether a reactive intermediate involved in the reaction is a carbocation, a carbanion or a free radical or whether the substrate is aliphatic or aromatic. Detailed understanding of a reaction type helps to predict the product outcome in a reaction. It also is helpful for optimizing a reaction with regard to variables such as temperature and choice of solvent.
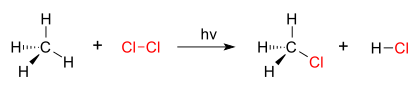
A good example of a substitution reaction is halogenation. When chlorine gas (Cl-Cl) is irradiated, some of the molecules are split into two chlorine radicals (Cl.) whose free electrons are strongly nucleophilic. One of them breaks a weak C-H covalentbond and grabs the liberated proton to form the electrically neutral H-Cl. The other radical reforms a covalent bond with the CH3. to form CH3Cl (methyl chloride).
| chlorination of methane by chlorine |
|---|
Subscribe to:
Comments (Atom)
-
There is no limit to the number of possible organic reactions and mechanisms. [5] [6] However, certain general patterns are observed that ...
-
My You tube online video link https://youtu.be/_nbMOdRHIgk
-
A List of Chemistry Laboratory Apparatus and Their Uses List of Basic Chemistry Apparatus In most labs, you'll encounter the...